
风力发电机
B .
天然气烧水
C .
硅太阳能电池
D .


| | 0 | 5 | 10 | 20 | … |
| | 0.0 | 8.96 | 15.68 | 22.40 | … |
下列判断正确的是( )
①加H2O ②加NaOH固体 ③将盐酸用量减半,浓度不变 ④加CuO固体 ⑤加NaCl溶液 ⑥加入硝酸钾溶液 ⑦降低温度(不考虑盐酸挥发)

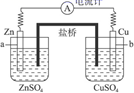
|
设计思路 |
||
|
负极 |
负极材料 |
|
|
负极反应物 |
||
|
正极 |
正极材料 |
|
|
正极反应物 |
||
|
电子导体 |
|
|
|
离子导体 |
|
|
在方框内画出简单的装置示意图,并标明使用的材料和试剂。


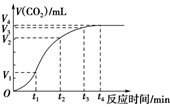
A.0~t1 B.t1~t2 C.t2~t3 D.t3~t4