



| 选项 | A | B | C | D |
| 装置 | | | | |
| 目的 | 分离NaCl和I2的固体混合物 | 分离Fe(OH)3胶体中的FeCl3 | 除去CO2中混有的SO2 | 用乙醇萃取碘水中的碘并分离 |

|
选项 |
实验操作 |
实验现象 |
实验结论 |
|
A |
向溶液中滴加稀硫酸,并将产生的气体通过澄清石灰水 |
产生无色无味的气体,且石灰水变浑浊 |
该溶液中含 |
|
B |
向5mL 0.1mol·L-1NaOH溶液中滴加5mL0.01mol·L-1MgCl2溶液,然后再滴加5mL0.01mol·L-1CuCl2溶液 |
先产生白色沉淀,后产生蓝色沉淀 |
Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
|
C |
向蔗糖中加入适量浓硫酸并不断搅拌,同时将产生的气体通入品红溶液 |
蔗糖体积膨胀并变黑,品红溶液腿色 |
浓硫酸具有脱水性和氧化性 |
|
D |
向淀粉溶液中加入足量稀硫酸,加热一段时间后,加入少量Cu(OH)2悬浊液 |
产生砖红色沉淀 |
淀粉水解成葡萄糖 |




已知:i.当微粒浓度低于10-5mol·L1时,认为溶液中不存在该微粒;
ⅱ.常温下,部分难溶物的溶度积常数如下表:
| 难溶物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| Ksp | 1×10-38 | 1×10-16 | 2×10-13 | 2×10-25 |
回答下列问题:
①M中同周期元素第一电离能由大到小的顺序为,原因为。
②M中结构片段“ ![]() ”中4个碳原子共线的原因为。
”中4个碳原子共线的原因为。
③M中的“ COOH”被称之为亲水基的原因为。

图I和图Ⅱ的堆积方式分别为和;二者的空间利用率之比为。
ⅰ.N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ·mol-1;
ⅱ.2NO(g)+O2(g)⇌2NO2(g) △H=-114.0kJ·mol-1;
ⅲ.2NO2(g)⇌N2O4(g) △H=-52.7kJ·mol-1。
回答下列问题:
①下列状态能说明上述反应达到平衡状态的是(填字母)。
a.NO浓度不再变化
b.混合气体的颜色不再变化
c.混合气体的密度不再变化
d.每消耗2molNO2 , 同时消耗1molN2O4。
②若起始时容器内总压强为p1 kPa,10s时容器内3个反应达到平衡状态,此时的总压强和N2O4的分压分别为p2 kPa和p3 kPa;则前10s内N2O4的平均生成速率为kPa·s-1 , 该温度下反应ⅲ的平衡常数Kp=kPa-1。
③若升高温度,平衡体系中NO的体积分数(填“增大”“减小”或“无法确定”),原因为。

①图中代表NO物质的量变化的曲线为。
②T1℃下,N2的平衡体积分数为。
 ,所需试剂和条件分别为。
,所需试剂和条件分别为。
 的合成路线(其他试剂任选):。
的合成路线(其他试剂任选):。
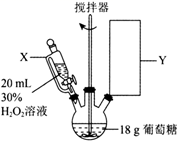
仪器X的名称为,Y处为冷凝回流装置,下列仪器使用正确且效果最好的是(填字母)。

用移液管取出三口烧瓶中的反应液2.00mL置于锥形瓶中,以酚酞作为指示剂并加20mL蒸馏水稀释,用0.04mol·L-1NaOH标准溶液滴定。
①滴定管使用的正确的操作顺序为蒸馏水洗涤→标准液润洗→→→→→洗净→放回滴定管架(填字母)。
a.滴定结束后,记录刻度
b.调节液面至0刻度或0刻度略靠下,记录刻度
c.装入标准液并排净尖嘴处的气泡
d.将未滴定完的标准液回收
②达到滴定终点时的现象为。
③滴定过程消耗NaOH标准溶液的体积为V0mL,反应后三口烧瓶内溶液的体积为V1mL,实验条件下葡萄糖的转化率为(用含V0和V1的代数式表示)。
④若滴定终点时俯视读数,对转化率的影响为(填“偏高”“偏低”或“无影响”)。
将CaCO3分散于适量蒸馏水中形成浊液,加入葡萄糖酸,至无CO2气体放出为止,煮沸,并趁热采用下图装置抽滤,滤掉未反应的CaCO3 , 得到澄清透明的葡萄糖酸钙溶液。

抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是。