
选项 | 操作 | 目的 |
A | 用剩的食盐放回原试剂瓶 | 避免浪费 |
B | 天平调平后在左、右托盘各垫一张相同的纸 | 保证称取的食盐质量更准确 |
C | 用50mL量筒替代天平量取所需的水 | 更加简便 |
D | 溶解时用玻璃棒搅拌 | 增加食盐的溶解能力 |

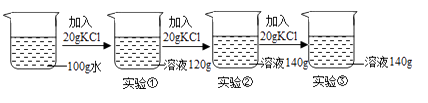
序号 | 温度/℃ | 水的质量/克 | 所加硝酸钾的质量/克 | 所得溶液的质量/克 |
① | 28 | 10 | 4 | 14 |
② | 28 | 10 | 6 | 14 |
③ | 60 | 10 | 8 | 18 |
 B . 粗盐溶解
B . 粗盐溶解  C . 浊液过滤
C . 浊液过滤  D . 蒸发结晶
D . 蒸发结晶 
 B .
B . 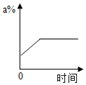 C .
C . 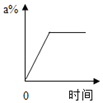 D .
D . 

温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
氯化铵溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
氯化钠溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
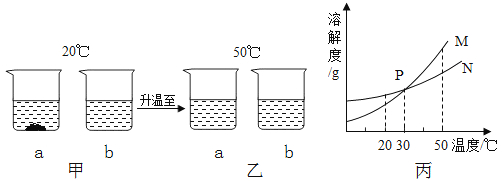
若不考虑水蒸发对实验的影响,请回答下列问题。
将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用(填仪器名称)滴加蒸馏水至刻度线.如图2所示,该同学观察方式正确的是(填序号).

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
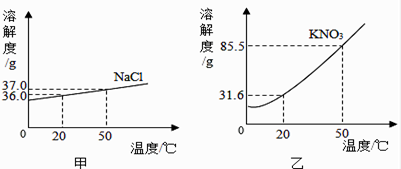
Ⅰ.20℃时,NaCl的溶解度是 g.
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果).
Ⅲ.KNO3中含少量氯化钠时,提纯硝酸钾的一般方法是.
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是.
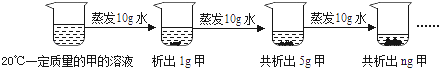
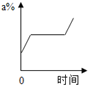
Ⅰ.蒸发前原溶液是(填“饱和”或“不饱和”)溶液.n的数值是.
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.


步骤如下:
①计算:可计算出需精盐克。
②称量和量取:称量氯化钠时,若发现天平指针向左偏(如图),则应怎么处理?
③溶解:
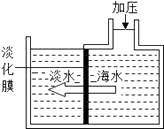
我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取实验的方法主要为“盐田法”,生产流程如下:

在蒸发池中促进水分蒸发,主要是利用了下列各项中的 .(填选项序号)
①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
金属镁广泛应用于生活、生产和国防工业,从卤水中提取镁的过程如图所示:

在上述转化过程中,①处发生的反应属于 反应.(填“中和”“复分解”“氧化”“化合”“分解”之一)
海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素.KCl和KNO3的溶解度曲线如图所示,试回答下列问题:

①t1℃时,KCl饱和溶液的溶质质量分数KNO3饱和溶液的溶质质量分数;(填“大于”“小于”“等于”之一)
②已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g,在20℃时,向盛有200g水的烧杯中加入80gKNO3 , 充分溶解,得到该温度时KNO3的(填“饱和”“不饱和”之一)溶液,若使烧杯内物质缓慢升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为 .(填最简整数比)
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 氯化钠溶解度(克) | 35.8 | 36.0 | 36.3 | 36.4 | 37.0 | 37.3 | 37.8 |
| 硝酸钾溶解度(克) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |

|
密度(g/mL) |
1.01 |
1.07 |
1.14 |
1.22 |
1.30 |
1.40 |
1.50 |
1.61 |
1.73 |
1.81 |
1.84 |
|
质量分数(%) |
1 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
98 |

有一物块A,其体积为250cm3 , 密度为1.30g/cm3。一只容器中盛有某硫酸溶液5千克,将物块A放入该溶液中静止后如图所示,此时物块A有2/15的体积露出液面。