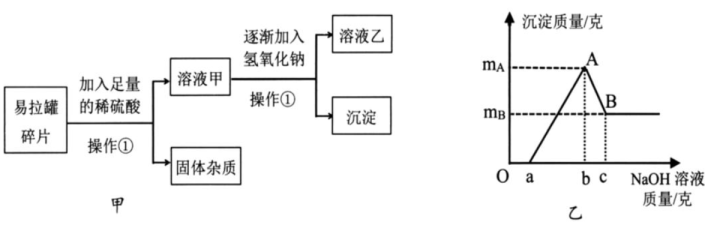
①滤渣中可能有铜 ②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有Mg(NO3)2、Zn(NO3)2和Fe(NO3)2 , 可能有Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量



 B .
B .  C .
C .  D .
D . 
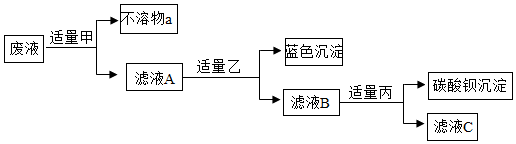
已知滤液B中只含有一种溶质,则下列说法不正确的是( )

下列说法中正确的是( )
①逸出气体若用碱石灰吸收,增重b克,则x偏小(碱石灰:CaO和NaOH的混合物)
②逸出气体若用碱石灰吸收,增重b克,则x偏大
③所得溶液蒸干并灼烧至恒重,得c克固体,灼烧时有固体飞溅出去,则x偏小
④所得溶液蒸干并灼烧至恒重,得c克固体,灼烧时有固体飞溅出去,则x偏大


 B . 向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸
B . 向等质量的锌粉和铁粉中,分别加入相同质量分数的稀盐酸  C . 常温下,向硝酸钾的不饱和溶液中加入硝酸钾晶体
C . 常温下,向硝酸钾的不饱和溶液中加入硝酸钾晶体  D . 向一定量的稀盐酸中加入过量的NaOH溶液
D . 向一定量的稀盐酸中加入过量的NaOH溶液 
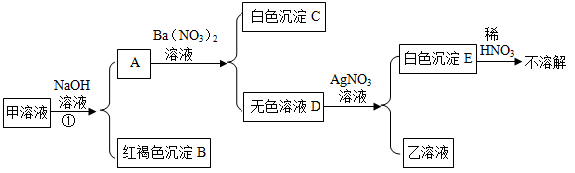
①往镁粉和氧化铜的混合物中加入过量稀硫酸,充分反应并过滤,得到滤渣甲和滤液A;
②往滴有无色酚酞的氢氧化钠和硝酸钡的混合溶液中,加入一定量的稀硫酸,充分反应并过滤,得到沉淀乙和无色滤液B;
③将滤液A和B充分混合后,得到沉淀丙和滤液C; ④往滤液C中滴加氯化钡溶液,没有沉淀产生。
回答下列问题:

小明在学习金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气,他想镁紧排在钠后面,它是否也能与水反应呢?
【提出问题】镁是否能与水反应?
【实验探究】在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂,实验过程和现象如图:
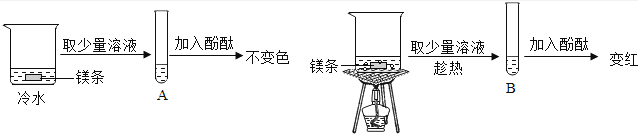
【反思与总结】
猜想 | 验证方案 |
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性减弱 | 将褪色后的溶液 , 如果溶液变红,说明小明的猜想正确 |
小明通过实验证明了自己的猜想是正确的。
硫燃烧产生的二氧化硫气体会造成空气污染。为避免二氧化硫污染空气,某教师对教材中“硫在空气和氧气中燃烧”的实验进行了改进与创新,设计了如图甲所示的实验装置:

【实验原理】
① B装置是燃烧匙固定在带有A导管的单塞上,硬质玻璃管透光性好,不影响实验现象的观察;
② C装置的广口瓶中盛放氢氧化钠溶液可吸收二氧化硫气体,避免污染;
③ 打开D装置中的阀门,气体就会从左向右依次进入装置。
【实验过程】
步骤一:将硫粉放在燃烧匙上,在空气中点燃后,迅速伸入硬质玻璃管内(如图B装置),打开阀门,观察硫在空气中燃烧的现象;
步骤二:将导管a伸入盛有氧气的集气瓶中(如图A装置),观察硫在氧气中燃烧的现象。
【交流讨论】
【拓展应用】
小丽同学认为,运用该装置设计原理,还能进行其它有毒气体的实验,同样能达到避免污染的目的。于是设计了图乙实验装置,用以完成“CO
还原氧化铜”实验。

图乙D装置在实验中除了形成气体定向流动外,还有的用途是 ;
设计与实验:同学们设计了甲图装置(固定装置未画出),将天然气在氧气中点燃后得到的混合气体通过该装置进行实验。开始时应 (填“先通气体”或“先加热”);加热过程中发现黑色CuO固体变红,澄清石灰水变浑浊。写出CuO固体变红的化学方程式 。
仅根据甲图装置出现的现象,写出混合气体所有的可能组成 。

评价与改进:小聪认为上述实验方案有缺陷,通过讨论,增加了乙图中的3个装置(固定装置未画出),对方案作了改进并进行实验:将混合气体先通过乙图中连接的装置后,再通入甲图装置。实验中部分现象如下:A装置质量增加,B装置中溶液不变浑浊,甲图装置中实验现象(1)相同。请你写出改进方案的装置连接顺序(装置不重复使用):混合气体→ →甲图装置(填装置编号)。

(3)交流与讨论:通过对改进实验的现象分析,同学们得出了正确的结论。
①取200g混合溶液加入足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;
②另取原混合溶液各200与含有杂质的废铁用反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
|
实验组别 |
一 |
二 |
三 |
四 |
五 |
|
混合溶液质量/g |
200 |
200 |
200 |
200 |
200 |
|
铁屑质量/g |
6 |
9 |
12 |
15 |
18 |
|
析出铜的质量/g |
6.4 |
9.6 |
m |
16 |
16 |
请分析计算:
| 装置丙 | 装置丁 | |
| 反应前 | 48.8克 | 161.2克 |
| 反应后 | 46.5克 | 163.9克 |
小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为11.5克,纯度为76.7%。
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程)。
资料:氢氧化铝是一种白色沉淀,可与氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化镁不与氢氧化钠反应。