| 选项 | A | B | C | D |
| 装置图 | | | | |
| 现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
| 结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
①氯气的性质很活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
③久置的氯水漂白性增强
④检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液看是否有白色沉淀生成
⑤除去Cl2中的HCl,可使气体通过饱和食盐水
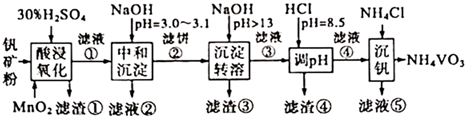
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | | | | | |
| 开始沉淀pH | 1.9 | 7.0 | 8.9 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 10.9 | 4.7 | 10.1 |
下列说法错误的是( )

①氯化钾②乙醇③醋酸④氨气⑤蔗糖⑥硫化氢⑦硫酸氢钠⑧一水合氨⑨氯气⑩碳酸钡⑪铁
①给试管中的药品加热,必须先 ,后集中加热.
②点燃可燃性气体(如H2、CO等)时,都要先 , 后点燃.
③H2还原CuO实验结束时,要先 ,后移去导气管.
(2)要分离下列四组混合物:a.饱和食盐水与沙子 b.从KNO3和NaCl的混合溶液中获得KNO3 c.水和汽油的混合物 d.CCl4液体与甲苯液体的混合物(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6℃)
①分离a、b的操作分别为 、 .
②上述四组分离时需使用酒精灯的有 和 (填序号).
③分离c时所使用仪器中有一种在其他组分分离时无需使用,这种仪器是
a.氧化剂 b.催化剂 c.脱水剂 d.酸
已知: 的熔点为
℃,沸点为
℃;
的沸点为
℃;
的熔点为
℃,沸点为
℃

请回答:

该学习小组按如图装置进行实验(部分夹持装置已省去),反应一段时间后,测得C中溶液的 ;已知:饱和NaClO溶液pH为11。
仪器a的名称为,装置A中发生反应的离子方程式为。
取C瓶溶液20.00mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应: 。用0.1000mol/LNa2S2O3标准溶液滴定该锥形瓶中的溶液,常选用作指示剂,当加入最后一滴Na2S2O3标准溶液时,其现象为,重复操作2~3次,Na2S2O3溶液的平均用量为20.00mL(已知:
)。计算C瓶溶液中NaClO的物质的量浓度为mol/L。

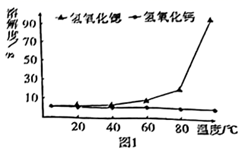
已知氢氧化锶和氢氧化钙在水中的溶解度曲线如图1所示。回答下列问题: