| W | X | |
| Y | Z |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别将少量钠投入盛有水和乙醇的烧杯中 | 钠与水反应更剧烈 | 乙醇中氢的活泼性比水中氢的弱 |
| B | 将石蜡油与碎瓷片混合加强热,产生的气体通入酸性KMnO4溶液中 | 酸性KMnO4溶液褪色 | 石蜡油加强热产生的气体是乙烯 |
| C | 将灼热后表面变黑的螺旋状铜丝插入约50℃的乙醇中 | 铜丝能保持红热,反应后溶液有刺激性气味 | 乙醇的催化氧化反应是放热反应 |
| D | 向苯酚钠溶液中通二氧化碳 | 溶液变浑浊 | 苯酚的酸性比碳酸的弱 |
 增大SO2的浓度
B .
增大SO2的浓度
B .  增大压强
C .
增大压强
C .  升高温度
D .
升高温度
D .  加入合适的催化剂
加入合适的催化剂

 。下列有关该中间产物的说法错误的是( )
。下列有关该中间产物的说法错误的是( )


已知:碱性连苯三酚溶液能吸收O2。

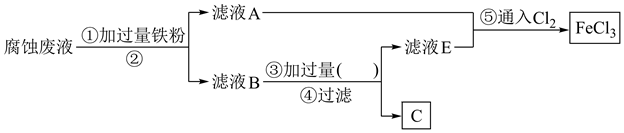
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为,③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。
Ⅰ.N2(g)+O2(g) 2NO(g) ΔH1=+180.0kJ/mol
Ⅱ.2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH2
请回答下列问题:
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①0~5min内,v正(CO2)=mol·L-1·min-1;该温度下反应的化学平衡常数K=(保留两位有效数字)L/mol。
②其他条件不变,升高温度,NO2的平衡转化率(填“增大”、“减小”或“不变”)。
③20min时,保持其他条件不变,再向容器中通入0.4mol CO、0.7mol N2和0. 4mol CO2 , 此时v正(填“ ”、“
”或“
”) v逆。