| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)=X(g)+Y(s) | ΔH>0 | 它是非自发反应 |
| B | W(s)+xG(g)=2Q(g) | ΔH<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g+5Y(g)=4W(g)+6G(g) | 能自发反应 | ΔH一定小于0 |
| D | 4M(s)+N(g)+2W(l)=4Q(s) | 常温下,自发进行 | ΔH>0 |
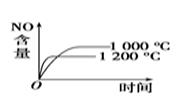
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
 B .
B .  C .
C .  D .
D . 

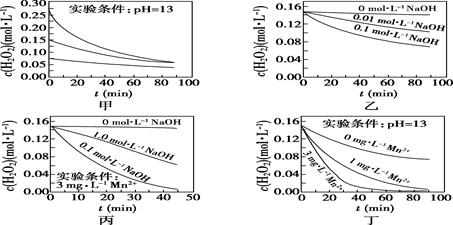
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |

若配制250 mL H2SO4溶液,则需用量筒量取密度为1.84 g·cm-3、质量分数为98%的浓硫酸mL。
仪器A的名称为。
|
实验 次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.6 |
26.6 |
26.6 |
29.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
31.2 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
①温度差的平均值为℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3 , 中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=(取小数点后一位)。
③上述结果与-57.3 kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
a.充入CO,使体系总压强增大b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大d.使用高效催化剂
下列情况能说明该反应达到平衡状态的是________。

若在容积为10 L的密闭容器中进行该反应,起始时充入0.4 mol NO2、0.2 mol O3 , 反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①实验a从开始至平衡时的反应速率v(O3)=;实验c中NO2的平衡转化率为。
②与实验a相比,其他两组实验改变的条件分别是b,c。
③M点的逆反应速率 v(逆)(填“>”“<”或“=”)N点的正反应速率v(正)。

①图中表示c(N2)t的曲线是。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-1 , 则此时v正v逆(填“>”“<”或“=”)。
H2SO4(aq)=SO2(g)+H2O(l)+O2(g)ΔH1=+327 kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq)ΔH2=-151 kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110 kJ·mol-1
①单位时间内生成n mol N2的同时生成2n mol NH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是(填字母)。
A.及时移出氨B.适当增大压强C.循环利用和不断补充氮气
D.减小压强E.降低温度

