| 配料:鲜牛奶 净含量:
营养成分(每
蛋白质
钙
保质期:8个月 |
【查阅资料】成人每天食用食盐的质量通常为6 g;某种加碘食盐的标签如图所示。
配料表:氯化钠、碘酸钾( 净含量:500 g 碘含量(以I计): |
【问题分析】500 g该品牌食盐中,含碘的最大质量是。
【结论】日常服用加碘食盐能否起到避免核辐射目的?,原因是。
产品标准号 |
GB5461—2000 |
配 料 |
精制食盐(NaCl)碘酸钾(KIO3) |
质量等级 |
一级 |
含 碘 量 |
(35±15)mg/kg |
食用方法 |
待食品熟后加入碘盐 |
储藏方法 |
密封保存、防潮防热 |
分装日期 |
见封口 |
| 二氧化氯消毒液1升 |
|
| 溶质的质量分数 |
60% |
| 密度 |
1.2克/厘米3 |
| 强腐蚀性,阴冷,密封储藏 |
|
|
加入NaOH溶液的质量/克 |
40.0 |
80.0 |
120.0 |
160.0 |
200.0 |
|
生成沉淀的质量/克 |
0.0 |
2.45 |
7.35 |
9.8 |
9.8 |

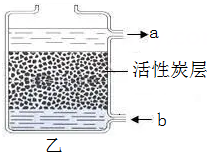
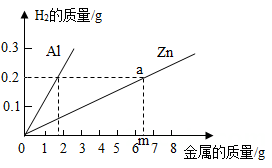
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量/g | 10 | 10 | 20 | 20 |
所加稀硫酸的质量/g | 100 | 120 | 80 | 180 |
生成氢气的质量/g | 0.2 | 0.2 | 0.2 | X |
①由图象可知:日前氢气的主要来源是(填“天然气和煤"、“醇类"或“水"),选择该原料制氢的可能原因是 ;
②电解水制氢需要消耗大量的电能,下列获取电能的方式中,一定存在碳排放的是(选填字母)。
A.水力发电
B.太阳能发电
C.燃煤发电
D.核能发电
①方法一:将氢气直接加压储存在由某种镁铝合金制造的储氢罐中备用。从物质分类的角度来看,镁铝合金属于 (填“纯净物"或“混合物");
②方法二:先通过Mg,Cu与氢气反应,将氢气转化为MgH2暂时“储存”起来,此为储氢反应(如图3);需要使用氢气时,可通过释氢反应实现: MgH2 +2HCl =MgCl2 +2H2↑。请写出储氢反应的化学方程式。 如果将储氢反应生成的MgH2全部与足量稀盐酸反应,则释放出来的H2质量参加储氢反应的H2质量(填“大于”、“等于“或“小于”)。
①从理论上讲,在其它条件相同的情况下,携带相同质量的燃料,氢内燃汽车要比普通燃油汽车行驶更远的距离,这主要是因为氢气的大;
②2013年,我国首辆氢燃料电池电动机车“蓝天号”成功运行。该车采用功率为150kW的电机,其转化为机械能的效率为90%,那么当该车以18m/s的速度匀速行驶时,能产生多大的牵引力?
农药A
规格: 100mL
质量分数: 20%
密度: 1.1g/cm3
求:

|
制氧剂成分 |
质量/包 |
|
A剂:过碳酸钠(Na2CO3) |
50克/包 |
|
B剂:二氧化锰(MnO2) |
5克/包 |
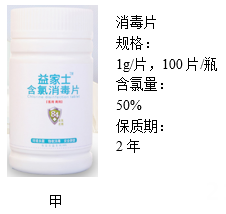
|
消毒对象 |
消毒液含氯浓度 |
|
食具果蔬 |
0.5% |
|
家庭环境 |
1% |
|
卫生洁具 |
2% |
|
污染物品 |
3% |
|
二氧化氯消毒液 1升 |
|
|
溶质的质量分数 |
60% |
|
密度 |
1.2克/厘米3 |
|
强腐蚀性,阴冷,密封储藏 |
|
①pH试纸 ②紫色石蕊试液 ③无色酚酞
|
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
|
|
加入氢氧化钠溶液的质量/g |
20 |
0 |
20 |
20 |
20 |
20 |
|
反应后溶液的质里/g |
144.5 |
164.5 |
179.6 |
189.8 |
200 |
220 |
|
每次产生沉淀的质量g |
0 |
0 |
m |
n |
9.8 |
0 |
请回答:

|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
硝酸钾(克) |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
80 |
100 |
|
溶解度/g |
21.8 |
39.7 |
48.8 |
47.3 |
46.4 |
45.1 |
44.7 |

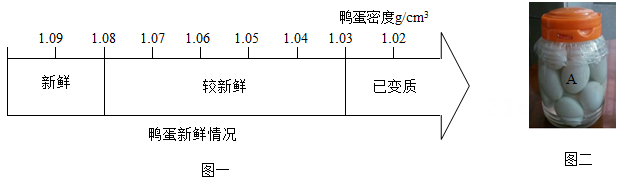
表一食盐溶液溶质质量分数与密度对照表
|
溶质质量分数 |
溶液密度 (g/cm}) |
|
2% |
1.01 |
|
6% |
1.03 |
|
10% |
1.07 |
|
15% |
1.10 |
(注:两种食盐仅NaCl中含有钠元素:35.1 g/100 g表示每100g食盐中含钠元素质量为35.1 g)
|
食盐种类 |
食盐A |
食盐B |
|
主要成分的含量 |
35.1 g/100 g(以钠元素质量计) |
93.0 g/100 g(以NaCl 质量计) |
|
二氧化氯( |
|
|
溶质质量分数 |
80% |
|
密度 |
1.2克/厘米3 |
|
强腐蚀性,阴冷,密封储藏 |
|

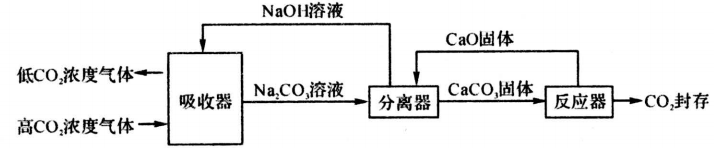
①“反应、分离”过程中发生的化学反应除了CaO+H2O=Ca(OH)2 , 还会发生另外一个反应,其化学方程式为A,通过这两个反应可以让NaOH循环利用起来。
②二氧化碳的资源化利用是一个世界性难题。2020年9月25日,二氧化碳加氢制甲醇的关键技术及工程示范项目通过了评估,该技术的大规模应用,让碳减排真正有利可图。二氧化碳加氢制甲醇的反应原理可以表示为:CO2+3H2催化剂
CH3OH+H2O。试计算生产4.8吨甲醇,可回收空气中的CO2多少吨?
充满电的蓄电池可供路灯连续工作多少小时?