 B . Na2O2含离子键和共价键
C . H2O2的电子式为
B . Na2O2含离子键和共价键
C . H2O2的电子式为实验 | 实验操作和现象 |
1 | 测得10mL0.1mol·L-1NaHC2O4溶液的pH约为5.5 |
2 | 向酸性KMnO4溶液中滴加过量0.1mol·L-1NaHC2O4溶液,溶液紫红色褪色 |
3 | 向0.1mol·L-1NaHC2O4溶液中加入等体积0.1mol·L-1Ba(OH)2溶液,溶液变浑浊 |
4 | 向10mL0.1mol·L-1NaHC2O4溶液中滴加少量0.1mol·L-1NaOH溶液,无明显现象 |
下列说法正确的是( )
反应I:(COOCH3)2(g)+2H2(g)CH3OOCCH2OH(g)+CH3OH(g) ΔH1<0
反应II:(COOCH3)2(g)+4H2(g)HOCH2CH2OH(g)+2CH3OH(g) ΔH2<0
压强一定的条件下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性[×100%]与温度的关系如图所示。下列说法正确的是( )

选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴入Na2S溶液,浊液变清 | C6H5O-结合H+的能力比S2-的弱 |
B | 将X溶液滴在KI淀粉试纸上,试纸变蓝色 | X溶液中一定含有I2 |
C | 向FeCl2和KSCN的混合溶液中滴入酸化的AgNO3溶液,溶液变红 | Ag+的氧化性一定比Fe3+的强 |
D | 向2支均盛有2 mL相同浓度Na3[Ag(S2O3)2]溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
①为确定所加Na2CO3的添加量,需测定NiSO4溶液的浓度。准确量取5.00mL溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,用0.04000mol·L-1EDTA(Na2H2Y)标准溶液滴定至终点(滴定反应为Ni2++H2Y2-=NiY2-+2H+),平行滴定3次,平均消耗EDTA标准溶液31.25mL。计算NiSO4溶液的物质的量浓度(写出计算过程)。
②生成NiCO3·2Ni(OH)2·2H2O时所发生反应的离子方程式为。
③若将NiSO4溶液加入到Na2CO3溶液中,会使沉淀中镍元素含量偏高,原因是。

①500-700K之间分解产生的气体为。
②800K后剩余固体质量略有增加的原因是。
①能发生银镜反应和水解反应。
②分子中有5种不同化学环境的氢原子。
③每个苯环上只含1种官能团。
 和
和 的合成路线(无机溶剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线(无机溶剂和有机溶剂任用,合成路线流程图示例见本题题干)。

①分批加入铬铁合金粉末并保持强制通风的原因是。
②其他条件相同,实验测得相同时间内铬铁转化率[×100%]、析出硫酸盐晶体的质量随硫酸浓度变化情况如图所示。当硫酸的浓度为9~11mol·L-1 , 铬铁转化率下降的原因:。(已知硫酸浓度大于12mol·L-1时铁才会钝化)



①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是。

①写出NO与ClO反应的离子方程式:。
②烟气中含有少量SO2 , 能提高NO的脱除率,可能原因是。
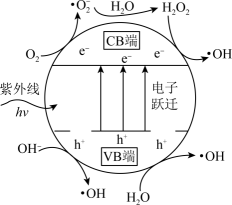
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是。