操作 | 现象 | 结论 | |
A | 将缠绕的铜丝灼烧后反复插入盛乙醇的试管,然后滴加酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙醇催化氧化生成乙醛 |
B | 向小苏打粉末中滴入柠檬酸 | 产生无色气体 | 柠檬酸的酸性比碳酸强 |
C | 将25℃、0.1mol·L-1Na2SO3溶液加热到40℃,用传感器监测溶液pH的变化 | 溶液pH逐渐减小 | 温度升高,Na2SO3水解平衡正向移动 |
D | 将苯、液溴、铁粉混合后产生的气体通入AgNO3溶液中 | 产生淡黄色沉淀 | 苯与液溴发生了取代反应 |



 )和β—萘磺酸(
)和β—萘磺酸(反应①:![]() +H2SO4=
+H2SO4= +H2O ΔH1<0 K1
+H2O ΔH1<0 K1
反应②:![]() +H2SO4=
+H2SO4=![]() +H2O △H2<0 K2
+H2O △H2<0 K2


已知:
I.As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O
II.As2S3(s)+3S2-(aq)2AsS
(aq)
III.砷酸(H3AsO4)在酸性条件下有强氧化性,能被氢碘酸等还原
下列说法错误的是( )
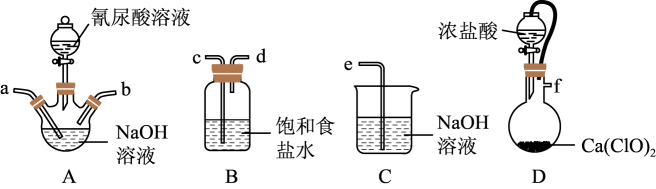



B中盛有一定量的(NH4)2SO4溶液,A中分液漏斗中的药品是。
已知:25℃时,当pH>4,Fe2+易被氧化。
步骤①生成FeC2O4·2H2O的化学方程式为,该步加入H2C2O4而不是Na2C2O4溶液的原因是。
产品中可能含有Fe2(C2O4)3、H2C2O4·2H2O杂质,为测定铁元素的含量,称取mg产品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃,再加入过量KMnO4溶液,充分反应后,向上述溶液中加入还原剂将Fe3+完全还原为Fe2+ , 再加入稀H2SO4酸化,在75℃继续用cmol·L-1KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液VmL。
铁元素的质量分数为,若第一次滴入KMnO4溶液不足,则产品中铁元素含量(填“偏高”或“偏低”)。

该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子 | Fe3+ | In3+ | Ga3+ | Cu2+ | Zn2+ | Pb2+ |
开始沉淀的pH | 2.2 | 2.1 | 2.6 | 4.6 | 6.24 | 7.1 |
完全沉淀(c=1.0×10-5mol·L-1)的pH | 3.2 | 3.4 | 4.3 | 6.6 | 8.24 | 9.1 |
HClO+H++2e-=Cl-+H2O φ=1.49+lg
AuCl4-+3e-=4Cl-+Au φ=0.994+lg
(φ与半反应式的系数无关,仅与浓度有关,cθ=1mol·L-1)
如图是Au的浸出率与NaCl溶液浓度的关系,请解释A点以后,金浸出率减小的原因是。

I.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H1
II.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H2=+173kJ·mol-1
III.CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.2kJ·mol-1
IV.C2H5OH(g)+2H2(g)=2CH4(g)+H2O(g) △H4=-156.2kJ·mol-1

①图1中c线对应的产物为(填“CO2”、“H2”或“CH4”)。
②图2中B点H2的产率与A点相等的原因是。

①出生成CO(g)步骤的化学方程式。
②下列措施可以提高CH3CH2OH在催化剂表面吸附率的有(填标号)。
a..减小乙醇蒸气的分压 b.增大催化剂的比表面积

N-N | N≡N | P-P | P≡P |
193 | 946 | 197 | 489 |
从能量角度看,氮以N2、而白磷以P4(结构式为 )形式存在的原因是,白磷中P原子的杂化方式为。
)形式存在的原因是,白磷中P原子的杂化方式为。

如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。

①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为(填标号)。

①![]() +R"OH
+R"OH +R'OH
+R'OH
②R—N=CH—OH![]()
试写出采用H2S、CH3OH及合适催化剂,由C制备D的合成路线。