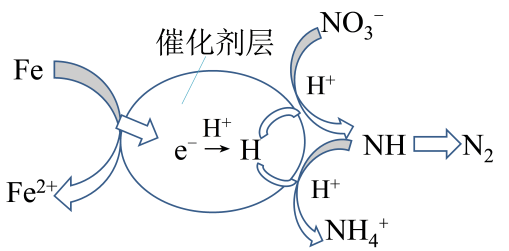


下列说法错误的是( )
实验 | 实验操作和现象 |
1 | 常温下,向4 mL 0.01 mol·L-1的KMnO4酸性溶液中加入2 mL 0.10 mol·L-1H2C2O4溶液,溶液褪色 |
2 | 常温下,测得0.10 mol·L-1NaHC2O4溶液的pH=a |
3 | 常温下,向0.10 mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4 mol·L-1 |
4 | 常温下,向0.10 mol·L-1Na2C2O4溶液中滴加等浓度盐酸至溶液的pH=7 |
下列所得结论正确的是( )
重整反应 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH
积炭反应Ⅰ 2CO(g)=CO2(g)+C(s) ΔH1=―172 kJ·mol-1
积炭反应Ⅱ CH4(g)=C(s)+2H2(g) ΔH2=+75kJ·mol-1
在恒压、起始投料比=1条件下,体系中含碳组分平衡时的物质的量随温度变化关系曲线如图所示。下列说法正确的是( )

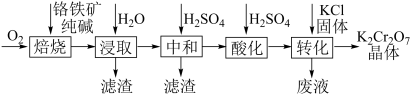

①钡盐沉淀法。先将K2Cr2O7酸性废液碱化处理,再加入BaCl2.废液需进行碱化处理的目的是。[已知:BaCrO4(s)Ba2+(aq)+ CrO
(aq) ΔH>0;Ksp(BaCrO4)=1.2×10-10]
②FeS还原法。在K2Cr2O7酸性废液中加入纳米FeS后,测得Cr(Ⅵ)和总铬去除率随时间的变化关系如图所示,反应过程中还检测到Cr2S3沉淀。10 min后,Cr(Ⅵ)和总铬的去除率升高幅度变小的可能原因是。

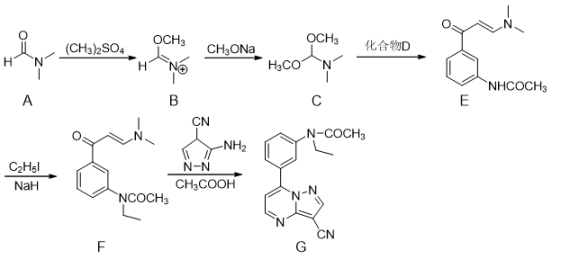
 , 则X→B的反应类型为。
, 则X→B的反应类型为。
①苯环上有4个取代基;②能发生银镜反应,存在4种不同化学环境的氢原子。
 。写出以苯酚和碘甲烷为原料制备
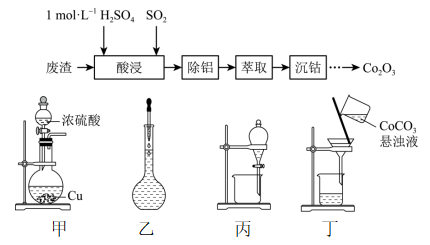
。写出以苯酚和碘甲烷为原料制备步骤Ⅰ:将足量废铁屑和 1.0 mol·L-1硫酸充分反应后,再与1.0 mol·L-1NH4HCO3溶液混合,装置如图1,反应结束后过滤并洗涤得FeCO3
步骤Ⅱ :将FeCO3溶于甘氨酸和柠檬酸的混合溶液,生成(NH2CH2COO)2Fe.当溶液中Fe(Ⅱ)浓度为0.5 mol·L-1时,(NH2CH2COO)2Fe产率随溶液pH的变化如图2所示。
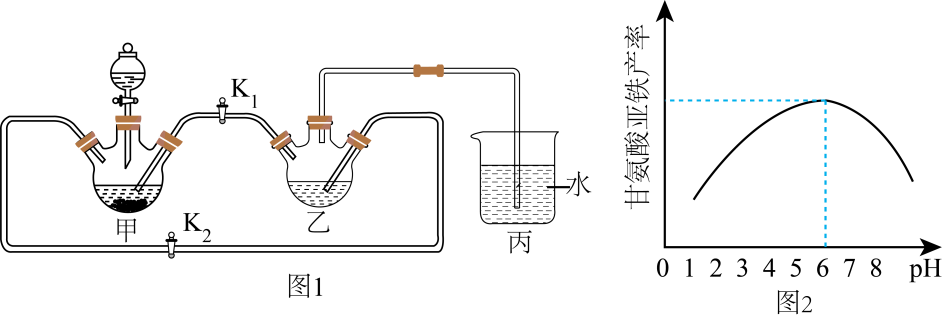
已知:①甘氨酸亚铁易溶于水,难溶于酒精;②甘氨酸具有两性,易溶于水;③柠檬酸易溶于水和酒精,具有强酸性和强还原性。


已知:ⅰ)在水中,ZVI表面的FeOH会因为质子化/去质子化作用而使其表面带正/负电荷,可表示为:FeOH+H+FeOH
, FeOH
FeO-+H+。pH约为8.1达到等电点,ZVI表面不带电。
ⅱ)pH<6时,ZVI去除Pb2+主要发生表面配位反应和还原反应:
2FeOH+ Pb2+
(FeO)2Pb + 4H+
2Fe+ 3Pb2++ 4H2O3Pb+2FeOOH + 6H+
①pH<6时,铁氧化物颗粒不易吸附Pb2+的原因是。
②pH<6时,随着pH增大,Pb2+的去除率会增大至接近100%的原因是。