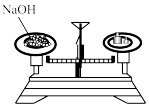
 B . 过滤
B . 过滤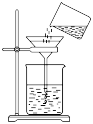 C . 将剩余钠放回试剂瓶
C . 将剩余钠放回试剂瓶 D . 转移溶液
D . 转移溶液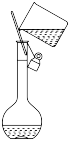
A.6gH2;B.0.5molCO2;C.1.204×1024个HCl分子;D.147gH2SO4;E.92g乙醇(C2H5OH);F.4℃时18mL水

①取20mL该溶液加入足量Zn粒有大量气体生成;
②取20mL该溶液加入Fe2O3后溶液变黄色;
③取20mL该溶液加入BaCl2溶液后有大量白色沉淀产生。
请回答下列问题:
①用少量蒸馏水洗涤烧杯内壁和玻璃棒 2-3 次,洗涤液均注入容量瓶,振荡
②在盛有 NaOH 固体的烧杯中加入适量水溶解
③将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④将容量瓶盖紧,反复上下颠倒,摇匀
⑤改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
⑥继续往容量瓶内小心加水,直到液面接近刻度线 1-2cm 处
该试验中两次用到玻璃棒,其作用分别是,。
⑦定容⑧冷却。其正确的操作顺序为。
①没有洗涤烧杯和玻璃棒
②未等 溶液冷却至窒温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容时仰视刻度线