 B . 取用盐酸
B . 取用盐酸 C . 搅拌溶液
C . 搅拌溶液 D . 放置滴管
D . 放置滴管
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g | 硫酸钠 | 4.9 | 9.1 | 19.5 | 40.8 | 48.8 | 46.2 | 45.3 | 44.3 | 43.7 |
硫酸铈 | 24.1 | 20.0 | 17.2 | 14.0 | 10.0 | 8.9 | 8.3 | 7.1 | 6.0 | |
下列说法正确的是( )
绿矾(FeSO4·7H2O)和硝(KNO3)均属于____(填序号)。
①加热绿矾,质量约减小1/5。该过程中绿矾失去部分水,生成FeSO4·4H2O。写出反应的化学方程式:。
②研碎FeSO4·4H2O和KNO3 , 研碎的目的是。
①以上三个反应中未涉及的反应类型是(填“化合”、“分解”、“置换”或“复分解”)反应。
②H2SO4和HNO3的水溶液中均含有的阳离子是(填符号)。

①甲烷燃烧时,(填“吸收”或“放出”)热量。
②与传统燃烧方式相比,化学链燃烧可避免燃料和空气直接接触,有利于捕集CO2 , 防止其大量排入空气,造成。
从空气反应器排出的气体中O2体积分数随反应温度变化关系如图所示。

①在800~1100℃间,升高温度,排出的气体中N2体积分数(填“增大”或“减小”)。
②空气反应器中最适宜的反应温度范围是(填序号)
A.800-900℃ B.900-1000℃ C.1000-1030℃ D.1030-1100℃
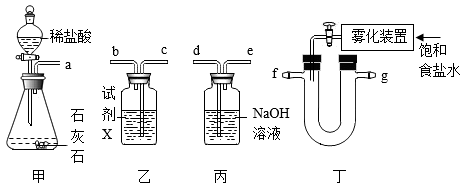
①甲装置中发生反应的化学方程式为。
②乙装置中试剂X可吸收HCl,但不与CO2反应,气流的进气接口为(填“b”或“c”)。
③上述四个装置的连接顺序为(填序号)。
A.甲乙丙丁 B.甲乙丁丙 C.甲丙丁乙 D.甲丁丙乙
①灼烧NaHCO3发生反应 , 若灼烧前后固体质量减少1.24g,则产品Na2CO3的质量为g。
②已知:NH4Cl和NaCl溶解度曲线如图所示。

向NH4Cl溶液中加入NaCl粉末,可使NH4Cl结晶析出。为使剩余的NH4Cl和NaCl混合溶液中的NH4Cl充分结晶析出,应采用的结晶方式是。
预测Al能和CuSO4溶液反应,理由是。
铝丝表面未出现红色物质,原因是。
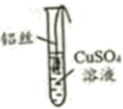
填写实验报告单:
序号 | 实验现象 | 结论与解释 |
① | 铝丝表面有少量气泡;铝丝周围出现蓝绿色物质 | CuSO4溶液呈弱酸性,与Al反应产生的气体是:蓝绿色物质成分待探究 |
② | 24h后,铝丝仍光亮;48h后,铝丝表面出现少量红色物质 | 红色物质是,说明Al能和CuSO4溶液反应,但反应较慢 |
③ | 铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色;两层溶液界面清晰 | 反应生成的Al2(SO4)3为无色;Al2(SO4)3溶液的密度(填“>” 或“<”)CuSO4溶液 |
资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
取出铝丝,将试管中的混合物分离得到蓝绿色固体。加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为。
下列食品不能长时间用铝制炊具盛放的是(填序号)。A.食醋 B.食用油 C.面粉 D.咸菜

①仪器a的名称是。
②团状MnO2应放在(填“试管底部”或“多孔隔板上”)。
③打开活塞K,经仪器a向试管中缓慢加入H2O2溶液至浸没团状MnO2 , 立即产生O2 , 收集完后,(填操作),反应随后停止。
①若烧瓶内压强过大,安全管中出现的现象是。
②当出现上述现象时,应采取的措施是。

可供选择的药品见表:
|
组别 |
药品 |
||||
|
铁粉/g |
碳粉/g |
水/滴 |
食盐/g |
其他 |
|
|
一 |
5.0 |
0.1 |
0 |
0 |
干燥剂 |
|
二 |
5.0 |
0.1 |
10 |
0 |
无 |
|
三 |
5.0 |
0.1 |
10 |
1.0 |
无 |
|
四 |
5.0 |
0.1 |
0 |
1.0 |
无 |
①600s内A瓶中O2含量几乎不变,B瓶中不断减少。实验表明,铁在空气中锈蚀是铁和O2、发生了化学反应。
②将第二组药品中的水改为迅速冷却的沸水,且用量增多至足以完全浸没固体混合物。600s内B瓶中O2含量也略有减少,主要原因是。
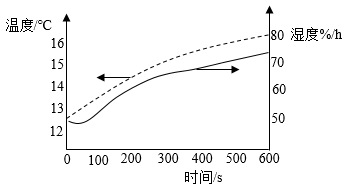

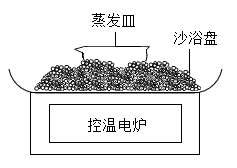
①浸取时,水温易升高的原因是。
②浸取后,混合物经(填操作名称)弃去废渣,得到浸出液。