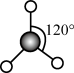


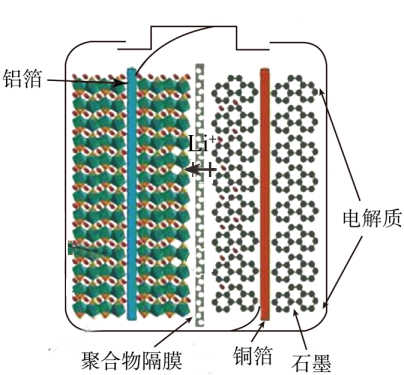
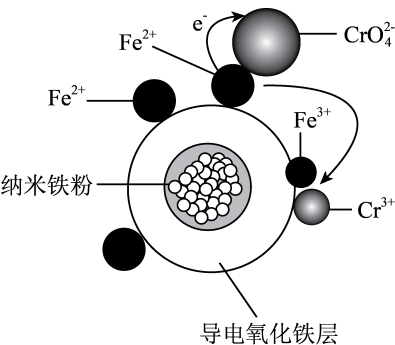
下列说法错误的是( )

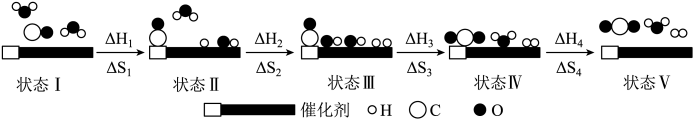
则下列说法错误的是( )
|
|
目的 |
方案设计 |
现象和结论 |
|
A |
检验未知溶液中是否含有铵盐 |
取一定量未知溶液于试管,滴入NaOH溶液并加热,试管口放置湿润红色石蕊试纸 |
试纸变蓝,说明溶液中含有铵盐 |
|
B |
探究碳酸钠溶液碱性是CO |
取2.0mL0.1mol/LNa2CO3溶液,滴入3滴酚酸,观察现象,再滴入3滴1mol/LBaCl2溶液 |
滴入酚酞溶液变红,再滴入BaCl2后出现白色沉淀,溶液颜色变浅 |
|
C |
比较AgCl和AgI的Ksp大小 |
向2.0mL0.1mol/LNaCl溶液中滴入2滴0.1mol/LAgNO3溶液,振荡静置,再滴入4滴0.1mol/LKI溶液,观察现象 |
先出现白色沉淀,后出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
|
D |
检验乙醇发生消去反应是否有乙烯生成 |
将乙醇在浓硫酸、170℃条件下产生的气体依次通过足量NaOH溶液,酸性高锰酸钾溶液 |
观察到酸性高锰酸钾褪色,可说明有乙烯生成 |
②固体混合物A中某化合物在高温下无水环境可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为。

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。
①0℃时,呈液态的是(填编号),其化学式为。
|
|
I |
II |
III |
IV |
|
熔点/K |
183.0 |
278.6 |
393.7 |
203.2 |
|
沸点/K |
187.2 |
427.2 |
560.7 |
330.8 |
②SiCl4与N-甲基咪唑(![]() )反应可以得到M2+ , 其结构如图所示:
)反应可以得到M2+ , 其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为,1个M2+中含有个σ键。

①已知化合物中Ge和O的原子个数比为1∶4,该化合物的化学式为。
②已知该晶胞的晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则该晶体的密度ρ=g•cm-3。用含a、b、c、NA的代数式表示)。

①图2可知,其他条件不变,随温度升高,CO2的平衡转化率先上升后下降,“先升高”的原因是;“后下降”的原因是由于设备腐蚀加剧等因素造成CO2的平衡转化率下降。
②下列说法正确的是。
A.图2两曲线中L1<L2
B.增大氨碳比有利于提高尿素产率,过量氨气能与水蒸气作用促进第二步反应正移
C.图3曲线M1>M2 , 增大水碳比有利于尿素生成
D.实际工业生产时,可选用初始条件为氨碳比L1和水碳比M1
③若已知M1>M0 , 请在图2中画出在初始L1和M1条件下,CO2的平衡转化率随温度变化曲线。
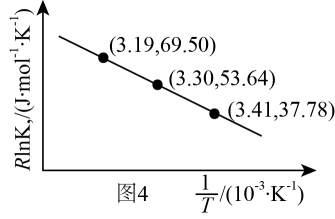
已知:RlnKp=-+C(C为常数)。根据图4计算该反应△H=kJ·mol-1。

已知:I.K2MnO4为墨绿色固体。
II.碳酸钾和高镒酸钾在不同温度时100g水中溶解度如表:
|
名称 |
20℃ |
30℃ |
50℃ |
60℃ |
100℃ |
|
K2CO3 |
52.5 |
53.2 |
54.8 |
55.9 |
60.9 |
|
KMnO4 |
6.4 |
9.0 |
16.9 |
22.2 |
48 |
回答下列问题:
a.100℃蒸发溶剂;
b.过滤;
c.自然冷却至室温;
d.趁热过滤;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
①IR检测显不:含有苯环,不含其他环状结构,含有![]() , 不含连续双键;
, 不含连续双键;
②1H-NMR显示:含有4种氢原子,其中苯环上含有2种氢原子。