
 。下列说法错误的是( )
。下列说法错误的是( )





 , 汞在第周期。
, 汞在第周期。
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
_Al2O3+_N2+_C—_AlN+_CO

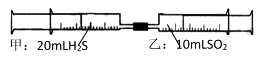
①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式)。
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为。

a.只有游离态b.只有化合态c.既有游离态也有化合态
a.是无色无味的有毒气体b.
与
反应生成不稳定的
c.有毒,不能用作食品加工d.
气体通入
溶液中产生白色沉淀
工业上常用漂白纸浆、毛、丝等,时间久了,漂白过的物质会发黄。简述原因。
①浓硫酸在空气中放置一段时间后浓度变小,体现了浓硫酸的(选填编号)。
a.吸水性b.挥发性c.脱水性d.强酸性
②利用现象,工业上用铁或铝制容器盛装冷的浓硫酸。
③浓硫酸在使下列物质发生转化时,只表现出强氧化性的是(选填编号)。
a.b.
c.C→
a.明矾:b.重晶石:
c.胆矾:
请书写溶于水的电离方程式。
a.铁 b.镁 c.锌

a.防护手套 b.实验服 c.防毒面具 d.护目镜
①该实验除有刺激性气味的气体产生外,还可能有现象;
②将产生的气体通入品红溶液,红色褪去,判断该气体中含有(写化学式),将产生气体先通过足量酸性高锰酸钾溶液,再通过澄清石灰水,石灰水变浑浊,判断该气体中还含有(写化学式),写出产生该混合气体的化学方程式;
③研究人员将产生的上述混合气体通入溶液,无明显现象,再通入氯气,则可观察到白色沉淀出现。试解释出现白色沉淀的原因。
④实验结束吸收尾气应该选用的装置是,烧杯中盛放的试剂是。



①氧化性;②还原性
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:。