 B . 滴加石蕊试剂
B . 滴加石蕊试剂 D . 测pH值
D . 测pH值

| 含氮 | 含磷 | 含钾 | |
| 土壤肥量标准(g/kg) | 0.62 | 0.34 | 17.8 |
| 测定结果(g/kg) | 0.50 | 0.36 | 18.1 |
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
| 序号 | 物质 | 杂质 | 试剂和方法 |
| A | MgO | Mg | 稀盐酸 |
| B | Fe粉 | Cu粉 | 稀盐酸、过滤 |
| C | CuCl2溶液 | CuSO4溶液 | 适量的氢氧化钡溶液,过滤 |
| D | CaCl2溶液 | 稀HCl | 过量的Ca(OH)2溶液 |

 B .
B .  C .
C .  D .
D . 



①小明首先将适量的饮料倒入一支洁净的试管中,然后滴加紫色石蕊试液,发现石蕊试液变红色。据此小明断定柠檬酸具有酸性,他做出这种判断的理论依据是。
②小红认为小明的实验结论不够严密,她建议在原来实验的基础上进行一步操作,把①中已经变红的混合液体加热,若看到,就能充分证明柠檬酸确实具有酸性了。


|
试管编号 |
A |
B |
C |
D |
E |
F |
|
加入CuSO4溶液的体积/毫升 |
0 |
0.5 |
1 |
1.5 |
2 |
4 |
|
加入水的体积/毫升 |
4 |
3.5 |
2.5 |
2 |
0 |
|
|
收集50毫升氢气所用的时间/秒 |
348 |
246 |
190 |
165 |
230 |
360 |

方法一:判断混合后反应物是否存在。
方法二:判断混合后生成物是否存在。

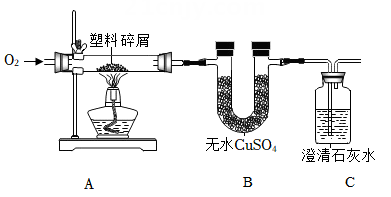
⑴B装置中的固体由白色变成蓝色;
⑵C装置中的澄清石灰水变浑浊
根据以上信息回答问题:
|
实验次数 |
1 |
2 |
3 |
4 |
5 |
|
样品质量/g |
30 |
30 |
30 |
30 |
30 |
|
稀硫酸质量/g |
30 |
90 |
120 |
1505 |
180 |
|
产生气体质量/g |
0 |
0.1 |
0.3 |
0.5 |
0.6 |
①食品袋内的“双吸剂”用铁粉而不用铁块的理由是。
②通过计算求30g样品中单质铁的质量。
①甲同学将样品置于烧杯中,逐渐加入某一浓度的盐酸,反应过程测得剩余固体质量和加入盐酸的质量关系如图a所示。
②乙同学进行如图b所示的实验,通过电子天平示数的减少来计算样品中碳酸钙的含量。


根据信息,请回答下列问题: