

(注:复合电极包含石墨、催化剂及放电时生成的Li2O2)


选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | CuCl2溶液 | b管中有气体逸出 |
B | 负极 | H2SO4溶液 | 溶液pH降低 |
C | 正极 | NaCl溶液 | U形管两端滴入酚酞后,b管中溶液呈红色 |
D | 负极 | AgNO3溶液 | a管中电极反应式是2H2O-4e-=O2↑+4H+ |
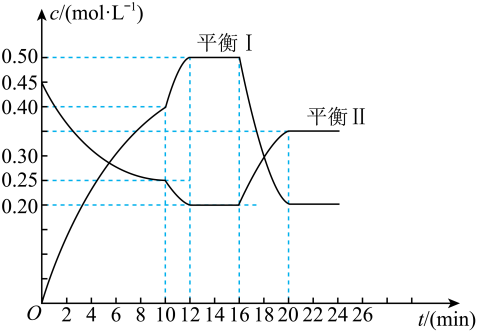

回答下面问题:

①M1=。
②在平衡状态x点时,CO2的平衡转化率为%。
③在平衡状态y点时,用百分含量表示的平衡常数K=。

①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是。
②若A点到E点,可采用的措施是(填序号,下同);从A点到C点,可采用的措施是;促进水的电离平衡的措施是。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH

①a电极是Al,写出电极反应,反应后b电极区溶液的pH(填“增大”“减小”或“不变”)。
②c电极是(填“正极”“负极”“阴极”或“阳极”),d电极的电极反应为。

①当闭合电键K时,电流表指针向左偏转,甲烧杯中溶液颜色逐渐变浅,则石墨电极a上发生反应(填“氧化”或“还原”),石墨电极b上发生的电极反应为。
②反应一段时间后,向甲烧杯中滴加KOH溶液,同时向乙烧杯中滴加硫酸溶液,发现电流表指针逐渐翻转,最后向右偏转,说明KMnO4与H2O2氧化性与有关。