
进行研究.
【收集资料】通过阅读标签及查阅资料,她获得如下信息:
⑴该固体酒精中含有酒精、氯化钙、氢氧化钠三种物质;
⑵酒精的化学式为 C2H5OH;
⑶氯化钙、氯化钡的水溶液均呈中性.
【提出问题】⑶酒精的化学式与 NaOH 相比,都有“OH”,那么酒精的水溶液是不是显碱性?⑷固体酒精中的氢氧化钠是否变质及变质的程度如何?
实验一:她取少量酒精溶液于试管中,滴加硫酸铜溶液,未观察到蓝色沉淀,说明酒精溶液(填“显”或“不显”)碱性.
除去部分变质的氢氧化钠溶液中的杂质,方法是(用化学方程式表示).

【方案一】设计实验证明反应物消失。

b点表示溶液中的溶质是 (写名称)。

实验现象:一段时间后,看到气泡从植物表面冒出,导管①的管口处有水排出,溶液呈绿色。将带火星的木条放在导管②的管口处,打开K2 , 木条复燃。
实验结论:。

①小徐的实验:取溶质质量分数为20%的稀硫酸30mL,用温度计测出其温度为13℃,然后向其中加入一定量的NaOH固体,一段时间后再用温度计测出溶液温度为22℃。由此,小明同学得出“NaOH与稀硫酸发生的中和反应是放热反应”的结论。
②小金的实验:用如图所示的实验装置(夹持等固定装置省略)。向烧瓶内的氢氧化钠溶液中滴入--定量的稀硫酸;观察到紅墨水在实验过程中向右移动了一段距离。由此,小天同学得出“NaOH与稀硫酸发生的中和反应是放热反应”的结论。请回答:

①甲中能观察到的明显现象是:。
②乙中的反应可用化学方程式表示为:。
③有同学将甲、乙两个实验后所得物质全部倒入丙实验后的烧杯中混合,静默一会儿,观察到上层溶液为无色,底部有白色沉淀。取少量上层溶液滴入足量稀盐酸,无明显现象。综合分析可知:实验后该上层溶液中一定含有的溶质是酚酞和,可能含有的溶质是。

|
溶液 |
白醋 |
盐酸 |
食盐水 |
草木灰水 |
石灰水 |
|
加入紫薯汁后的颜色 |
红色 |
红色 |
紫色 |
绿色 |
绿色 |
①图1中放置试管的仪器名称是。
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是。


查阅资料:氧化亚铁与稀硫酸、铁与硫酸铁反应均可生成硫酸亚铁。
小萍进行了如下猜想:
①只有生成的氯化钙;②氯化钙和氯化氢;③氯化钙和碳酸钙。


活动一:通过小组合作,同学们完成了如图甲所示的三组小实验。

活动二:小科将六支试管中的剩余物倒入一个洁净的大烧杯中,充分搅拌、静置,观察到杯内上层是无色溶液,下层有白色沉淀 (如图乙)。
[提出问题]上层溶液中可 能含有什么离子?
[猜想与假设]上层溶液中一定含有Na+、Cl- , 一定没有H+ , 可能含有OH-、CO32-、Ca2+中的一种或几种。
[进行实验]
|
实验步骤 |
实验现象 |
实验结论 |
|
|
方案一 |
取少量溶液于试管中,滴加无色酚酞试液 |
溶液变红 |
有OH- |
|
方案二 |
另取少量溶液于试管中,滴加稀盐酸 |
? |
有OH-和CO32- , 无Ca2+ |
[反思与评价]

那试管内的白色固体是什么呢?
他查阅资料得知:①吹出的气体主要成分有氮气、二氧化碳和水蒸气;
②过氧化钠与氮气不反应。
[提出猜想] 猜想1:CO2参加反应,固体成分是Na2CO3;
猜想2:H2O参加反应,固体成分是NaOH;
猜想3:CO2和H2O均参加反应,固体成分是Na2CO3和NaOH。
[实验验证] 取残留白色固体于试管中配成溶液,向其中加入溶液,产生白色沉淀;静置后取适量的上层清液于试管中,向其中滴加无色酚酞,溶液变红。
[实验结论] 猜想正确。
[拓展延伸] 化工厂存有过氧化钠时,一旦失火,不能选用(填字母序号,可多选)灭火。
A.二氧化碳 B.细沙 C.水
探究稀硫酸与氢氧化钠溶液的反应:
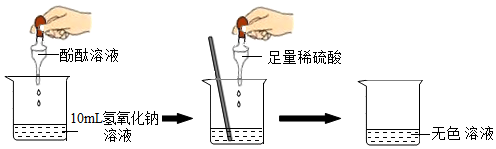
探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。他们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,如下表:
|
实验方案 |
实验步骤 |
实验现象 |
实验结论 |
|
实验一 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
稀硫酸过量 |
|
实验二 |
取样,滴入几滴紫色石蕊试液 |
溶液变红 |
稀硫酸过量 |
①上述实验方案中,方案一不合理,理由是。
②请你再设计一个确定稀硫酸是否过量的实验方案,写出选用的药品、预期实验现象及结论

[实验步骤]
①小科将A、B盐加入到装有少量水的大试管中,充分振荡制取硝酸钾,如图甲。
②小宁向大试管中依次加入浓度为10%的酸溶液15g,浓度为15%的破溶液8g,充分振荡制取硝酸钾,如图乙。
[实验分析]
①取少量A、B盐溶液,分别滴加稀盐酸,A盐溶液有气泡生成,B盐溶液无明显现象。
②另取少量A、B盐溶液,分別滴加氢氧化钠溶液,A、B盐溶液均无明显现象。
则B盐可能是(写出一种即可)
【查阅资料】下图是某品牌茶垢清洁剂说明书中的部分内容。
|
主要成分:过碳酸钠(化学式为2Na2CO3·3H2O2) 去渍原理:过碳酸钠溶于水时生成碳酸钠(俗称纯碱)和过氧化氢······ |
【提出问题Ⅰ】茶垢清洁剂溶于水时生成过氧化氢,是否生成氧气?
【实验1】在盛有茶垢清洁剂固体的小烧杯中,加适量常温水,完全溶解后得到无色溶液,观察到有小气泡缓慢冒出,伸入带火星的木条,木条不复燃。
【实验2】取三份等量的实验1中的溶液,分别加入甲、乙、丙三支试管中,按下图所示进行实验。观察到都较快产生气泡,且温度越高产生气泡越快;伸入带火星的木条,木条都复燃。

【表达交流Ⅰ】通过实验证明,茶垢清洁剂溶于水时生成氧气。实验1中“木条不复燃”的原因是
【提出问题Ⅱ】茶垢清洁剂溶于水时生成碳酸钠,是否生成氢氧化钠?
【实验3】取实验2丙试管内溶液,按下图所示流程进行实验。

【表达交流Ⅱ】实验中溶液M呈无色,你得出的结论是
【反思总结】
⑴茶垢清洁剂溶于水生成了碳酸钠和过氧化氢。碳酸钠溶液有较好的去污效果,过氧化氢分解生成活性氧,可深层带走污垢。
⑵使用茶垢清洁剂时应选择的水进行溶解,去垢效果更好。

[作出猜想]猜想一:只含氯化钠;
猜想二:可能含氯化钠和氯化钡;
猜想三:可能含有氢氧化钠、氯化钠和硫酸钠;
猜想四:……
小组同学经过进一步分析,否定了猜想三,理由是;
[得出结论]滤液中的溶质一定含有;


观察到的现象:①烧杯内壁上的澄清石灰水变浑浊;②试管A中无色酚酞试液变红,试管B中无色酚酞试液不变色。
实力的绽放。某同学利用所学知识制作一支“氢燃料火炬”。实验步骤如下:
步骤1:连接发生装置(如图),检查气密性:
步骤2:选取一定量的稀盐酸与锌粒反应制取氢气;

步骤3:将产生的氢气在导管口点燃,就制得一支迷你火炬;
步骤4:残渣处理,再将所有装置进行多次洗涤。

方法一:判断混合后碳酸氢钠或氢氧化钠是否存在。
方法二:判断混合后是否生成了碳酸钠。
小常先做了如图甲、乙两个实验,都没有明显现象。
【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氧化钠和碳酸钠的混合物。
步骤1:取灰白色固体于烧杯中,加入适量的水充分溶解过滤,得到滤液。
步骤2:取少量步骤1中的滤液于试管中,滴加2滴酚酞试液,溶液变成红色。
【得出结论】白色固体的成分是氧化钠。
有同学认为通过上述实验得出的结论不正确,其理由是。
步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,则假设不成立。
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
| 与盐酸反应的产物 |
FeCl2和H2O |
FeCl3和H2O |
FeCl2、FeCl3和H2O |

已知:氨水呈碱性(主要成分NH3•H2O是一种碱);(NH4)2CO3溶液呈碱性,40℃以上易分解。
根据以上信息回答下列问题:





[演示实验]将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中。
[提出问题]实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
[假设猜想]针对疑问,大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的猜想是。
[实验探究]①丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
|
实验方案 |
a.测溶液pH |
b.滴加Na2CO3溶液 |
c.滴加BaCl2溶液 |
|
实验操作 |
|
|
|
|
实验现象 |
试纸变色,对比标准比色卡,pH<7 |
有气泡产生 |
产生白色沉淀 |
|
实验结论 |
溶液中有H2SO4 |
溶液中有H2SO4 |
溶液中有H2SO4 |
[得出结论]通过探究,全班同学一致确定 猜想二是正确的。
[评价反思][实验探究]②中存在两处明显错误,实验操作中的错误是;实验方案中错误的是。


①盐酸是氯化氢气体溶于水形成的水溶液,在盐酸中存在氢离子、氯离子和水分子。 ②氯化氢气体也可溶于甲苯(一种有机溶剂),氯化氢的甲苯溶液中氯化氢以分子的形式 存在。盐酸与氯化氢的甲苯溶液的微观示意图如图 1 所示。 ③为此,向盛有 NaHCO3粉末的试管中通入 HCl 气体,无明显现象;停止通气后,再加入 少量水,试管内则反应生成气体。 ④紫色石蕊滴加入盐酸溶液而变红,紫色石蕊加入氯化氢的甲苯溶液中无明显现象。 请回答下列问题:


已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。