选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 纯碱是强碱弱酸盐 | 用纯碱溶液可清洗油污 |
B | 不锈钢合金 | 不锈钢在潮湿环境中容易被腐蚀 |
C |
|
|
D |
| 常温下可用铜与浓硝酸制取 |

①;②
溶液
;③
溶液;④
稀




B中盛一定量的NaOH溶液,A中应预先加入的试剂是.实验开始时先将止水夹E打开,C中收集到气体的主要成分是.
①取新鲜菠菜切开表皮,在内部组织上滴加KSCN溶液,无颜色变化,说明菠菜中铁元素不以(填离子符号)形式存在.
②另取新鲜菠菜洗净、烘干,放入坩埚中灼烧成灰烬.冷却后将灰烬移入烧杯中,加入溶液至没有气体产生,加蒸馏水稀释,充分搅拌后过滤.取少量滤液于试管中,加入KSCN溶液,溶液变为色,由此推断滤液中有
.实验中加入
溶液的目的为.
a.光束通过该液体时形成光亮的“通路”
b.将该液体进行过滤,可得到红褐色固体
c.将该液体加热、蒸干、灼烧后,有氧化物生成
d.向该液体中加入硝酸银溶液,无沉淀产生
①该过程反应的离子方程式为。
②人们可利用作强氧化剂溶解铜矿石(
),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:。
_Cu2S+_Fe3++_H2O_Fe2++_Cu2++_+_

步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/L KMnO4溶液至恰好完全反应(反应原理为:MnO+5Fe2++8H+=Mn2++5Fe3++4H2O),消耗KMnO4溶液20.00mL;
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。
①步骤三中灼烧所得残留固体的化学式为。
②已知:Fe2+的氧化率=×100%
根据以上数据,计算该绿矾样品中Fe2+的氧化率,写出计算过程。
请写出碳酸钠水溶液中通入气体的化学方程式。

图中①处填,②处填。
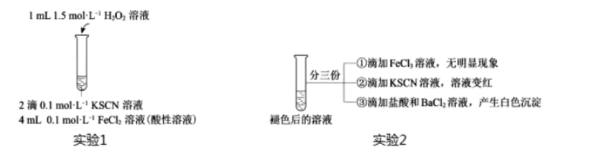
用实验2探究“红色褪去”的原因,则红色褪去的原因是。

请回答下列问题。