
已知:


|
选项 |
实验目的 |
实验及现象 |
结论 |
|
A |
比较 |
分别测浓度均为 |
|
|
B |
检验铁锈中是否含有二价铁 |
将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
铁绣中含有二价铁 |
|
C |
探究氢离子浓度对 |
向 |
增大氢离子浓度,转化平衡向生成 |
|
D |
检验乙醇中是否含有水 |
向乙醇中加入一小粒金属钠,产生无色气体 |
乙醇中含有水 |
实验 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法错误的是( )

选项 | 实验目的 | 选用试剂(或操作) | 实验装置 |
A | 验证Fe2+和Br-的还原性强弱 | 取适量FeBr2溶液,通入少量Cl2(不能与任何微粒完全反应),一段时间后,将溶液放入CCl4中摇匀、静置 | 甲 |
B | 制备氢氧化亚铁 | 取新制FeSO4溶液,滴加NaOH溶液 | 乙 |
C | 除去CO2中少量的SO2、H2O(g) | 试剂a为饱和碳酸钠溶液 | 丙 |
D | 制备AlCl3固体 | 蒸发AlCl3饱和溶液 | 丁 |


实验 | 实验操作和现象 |
1 | 常温下,向4 mL 0.01 mol·L-1的KMnO4酸性溶液中加入2 mL 0.10 mol·L-1H2C2O4溶液,溶液褪色 |
2 | 常温下,测得0.10 mol·L-1NaHC2O4溶液的pH=a |
3 | 常温下,向0.10 mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4 mol·L-1 |
4 | 常温下,向0.10 mol·L-1Na2C2O4溶液中滴加等浓度盐酸至溶液的pH=7 |
下列所得结论正确的是( )
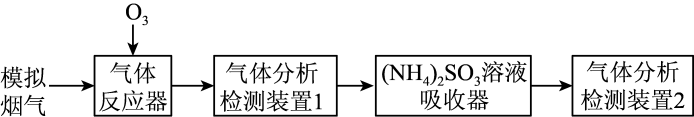
|
反应 |
平衡常数(25℃) |
活化能(kJ/mol) |
|
a: |
1.6×1057 |
3.17 |
|
b: |
6.2×1034 |
3.17 |
|
c: |
1.1×1041 |
58.17 |
①已知: , 则
。
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,SO2和NO的转化率随O3的浓度的变化如图。结合数据分析NO的转化率高于SO2的原因。


①(NH4)2SO3溶液显碱性,用化学平衡原理解释:。
②O3的浓度很低时,SO2的脱除率超过97%,原因是。
③在吸收器中,SO与NO2反应生成
和
的离子方程式是。
④在吸收器中,随着吸收过程的进行,部分被转化为N2 , 反应中
和N2的物质的量之比为1:1,该反应的离子方程式是。