 C . 点燃酒精灯
C . 点燃酒精灯 D . 洗涤试管
D . 洗涤试管
选项 | 实验目的 | 实验方案 |
A | 比较铝和锌的金属活动性强弱 | 将铝片和锌粒分别放入硫酸铜溶液中,观察现象 |
B | 除去氧化钙中少量的碳酸钙 | 将固体混合物高温煅烧至质量不再减少 |
C | 鉴别化肥氯化钾和氯化铵 | 取少量样品,分别加入熟石灰研磨,闻气味 |
D | 检验氢氧化钠溶液是否变质 | 取少量样品,滴加澄清石灰水,观察是否产生沉淀 |
铁是生活中使用最广泛的金属,活泼性较强,铁元素属于人体必需微量元素之一。
我国在春秋时期就开始了铁的冶炼,汉代出现了最早的炼铁高炉。
“苟利国家生死以,岂因祸福避趋之。”林则徐修筑洪泽湖大堤,所展现出的勤政爱民、甘于奉献是其一生赤子情怀的缩影。林则徐用生铁铸成铁锅(如图1),放在条石的齿槽之间,再浇上由糯米汁与熟石灰搅拌而成的砂浆,使得条石与条石牢牢地黏合在一起,不留丝毫缝隙,做到了针插不进、水泼不进。他还在每一块铁锔上刻上自己的名字,以表示对其修筑的工程终身负责。如今一百九十多年过去了,洪泽湖大堤依然固若金汤。

①说明铸造铁锔的生铁具有的物理性质是。
②砂浆中的熟石灰与空气接触,发生反应的化学方程式是。
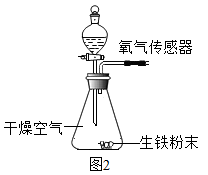
序号 | 实验操作 | 3分钟时氧气的含量 |
Ⅰ | / | 21% |
Ⅱ | 打开分液漏斗活塞,滴加2mL蒸馏水,关闭活塞 | 15% |
Ⅲ | 打开分液漏斗活塞,滴加2mL食盐水,关闭活塞 | 8% |
Ⅳ | 打开分液漏斗活塞,滴加2mL溶质质量分数为10%的稀盐酸,关闭活塞 | 13% |
①由实验Ⅱ、Ⅲ可知,加速铁生锈的物质是。
②能说明铁生锈需要水的证据是。
③实验Ⅳ中氧气含量下降的原因可能是。
工业上采用接触法制硫酸:先煅烧黄铁矿得到SO2 , 再将SO2经过一系列变化得到硫酸。SO2中硫元素的化合价是。
用温度计的水银球一端蘸取浓硫酸,取出后在空气中放置一段时间,观察到温度计示数上升,是因为浓硫酸能吸收,并放出热量。

①取(填“A”或“B”)中的氢氧化钠溶液5mL加入烧杯中,并插入pH计。
②从另一试剂瓶中取出稀硫酸逐滴加入①的溶液中,并用(填仪器名称)不断搅拌。反应过程中溶液pH变化的部分数据如下表所示:
稀硫酸体积/mL | 0 | 2 | 4 | 6 | 8 | …… |
溶液pH | 13.1 | 12.8 | 12.3 | 11.5 | 10.4 | …… |
③在pH=12.8时,溶液中的溶质是(填化学式)。
④滴加稀硫酸过程中,溶液pH不断减小的原因有:
a.硫酸与氢氧化钠发生了反应;
b.
⑤为证明溶液pH从13.1减小到10.4的过程中,④中原因a起主要作用,需设计的实验方案是。
某工厂现有含碳酸钠的废水需要处理。为测定废水中碳酸钠的质量分数,化学兴趣小组同学取废水样品100g,加入溶质质量分数为10%的硫酸溶液9.8g,恰好完全反应,反应的化学方程式: (此废水中其他物质不与硫酸反应)。计算废水中碳酸钠的质量分数(写出计算过程)。