 B . 二氧化碳的电子式:
B . 二氧化碳的电子式: D . 基态Cr原子的价层电子轨道表示式:
D . 基态Cr原子的价层电子轨道表示式: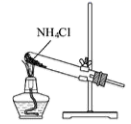 制取氨气
B .
制取氨气
B . 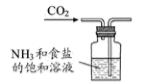 制取碳酸氢钠
C .
制取碳酸氢钠
C . 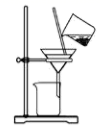 分离碳酸氢钠
D .
分离碳酸氢钠
D . 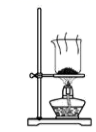 干燥碳酸氢钠
干燥碳酸氢钠


选项 | 探究方案 | 探究目的 |
A | 用pH计测量浓度均为0.1mol/L的醋酸和盐酸,比较两溶液pH大小 |
|
B | 向2mL 1mol/L NaOH溶液中滴加2滴0.1mol/L | |
C | 向盛有 |
|
D | 向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 | 氧化性: |

①白磷()是分子晶体,易溶于
, 难溶于水,可能原因是。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是(填字母序号)。

a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取杂化
c.黑磷能导电 d.黑磷属于混合型晶体
①实验测定磷化铝和磷化铜的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是,已知晶胞边长a pm,阿伏加德罗常数为 , 磷化硼晶体的密度是


过程ii的离子方程式是。

写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:。


下列说法正确的是____。
写出中间产物的结构简式X;Y;Z。
i.
ii.……
写出ii的离子方程式:。

为减少的生成,“浸锰”的适宜温度是,向过滤II所得的滤液中加入
溶液时温度不宜太高的原因是。
I.取固体产品1.160g于烧杯中,加入过量稀充分振荡,再加入NaOH溶液至碱性,发生反应:
;
II.加入过量KI溶液和适量稀 , 沉淀溶解,溶液变黄;
III.取上述混合液的于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/L
溶液进行滴定,发生反应:
, 滴定终点时消耗
溶液20.00mL。
①写出II中反应的离子方程式;
②判断滴定终点的方法是;
③假设杂质不参与反应,则产品纯度为。(保留四位有效数字)
方案1
实验装置 | 加入液体试剂 | 反应现象 |
| 10mL 30% | 开始无明显现象,静置10小时后,溶液变为浅蓝色,铜片上有少量蓝色沉淀,之后不再有明显变化 |
i.还原反应
ii.氧化反应
i.增大 , 增强
的氧化性
ii.降低,增强Cu的还原性
编号 | 加入液体试剂 | 反应现象 |
方案2 | 10mL30% | 开始产生少量气泡,溶液变为蓝色,片刻后,反应越来越剧烈,甚至形成大量泡沫涌出(经检测,生成气体可使带火星木条复燃),反应后剩余铜片表面光亮 |
方案3 | 10mL 30% | 生成较多气泡,溶液变为深蓝色。一段时间后,反应逐渐变慢,此时铜片上覆盖少量蓝色沉淀物。 |
方案2与方案3均在一定程度上加快了反应。
①方案2中,生成气体明显更剧烈的原因是。
②方案3中发生主要反应的离子方程式为。
③试评价方案2在回收铜过程的优缺点。
编号 | 加入液体试剂 | 反应现象 |
方案4 | 10mL 30% 2mL 5mol/L氨水 同时加入少量固体 | 生成较多气泡,溶液变为深蓝色。反应后铜片变薄且表面光亮。 |
试分析的作用。
①用离子方程式表示上述反应原理。
②通常条件下,含的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因。