
实验编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
1 | Mg、Al | 稀盐酸 | 指向铝 |
2 | Al、Cu | 稀盐酸 | 偏向铜 |
3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
4 | Mg、Al | NaOH溶液 | 偏向镁 |
根据上表中记录的实验现象,下列说法错误的是



编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Mg、Al | 稀硫酸 | 偏向Al |
2 | Cu、Al | 稀硫酸 | …… |
3 | Mg、Al | NaOH溶液 | 偏向Mg |
根据上表中记录的实验现象,推断下列说法正确的是

实验装置 |
装置一 |
装置二 |
装置三 |
装置四 |
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是

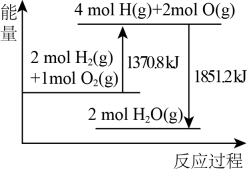


①若两个电极分别是锌、铜,电解质溶液是稀硫酸,正极的电极反应式;
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠时,该原电池的负极为;该原电池的电池总反应为;
③若电池的总反应是 , 正极反应式是;若该电池反应消耗了0.1mol
, 则转移电子的数目约为。

已知反应CO(g)+2H2(g)CH3OH(g)中相关的化学键键能数据如表:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①若有1molCH3OH生成,反应需要(填“吸收”或“放出”)kJ能量。
②某温度下,某定容容器中充入1molCO和2molH2发生上述反应,对于该反应,下列说法正确的是。
A.反应过程中n(CO):n(H2)不变
B.若容器内气体密度不变,说明反应达到平衡
C.升高温度,正反应速率减小
D.n(CO):n(H2);n(CH3OH)=1:2:1说明反应已达平衡
反应I.CO2(g)+3H2(g)CH3OH(g)+H2O(g)
反应II.CO2(g)+H2(g)CO(g)+H2O(g)
温度为T℃时,在一个刚性容器中模拟工业上合成CH3OH,往容器中通入1molCO2、3molH2进行反应,反应过程中容器内的压强随着时间变化如表所示。
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
压强/MPa | 120 | 105 | 95 | 90 | 88 | 88 |
请计算反应开始至40min时,CH3OH的平均反应速率MPa/min;平衡时n(CH3OH)是n(CO)的4倍,则H2的平衡分压是MPa。(分压=总压×气体物质的量分数)

请写出电极a上的电极反应式。
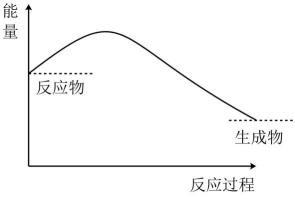
该反应为反应(填“吸热”或“放热”)。
实验编号 | 水果种类 | 电极间距离/cm | 电流 |
|
1 | 番茄 | 1 | 98.7 | |
2 | 番茄 | 2 | 72.5 | |
3 | 苹果 | 2 | 27.2 |
该实验目的是研究水果种类和对水果电池电流大小的影响。

由图中数据分析,该反应的化学方程式为。
I.
II.
则与
反应生成
和
的热化学方程式为。若该反应在恒温、恒容体系中进行,达到平衡的标志为(填选项字母)
A.的质量保持不变
B.、
、
和
的物质的量之比为1:1:1:1
C.的正反应速率为零
D.在给定条件下,可逆反应完成程度达到最大

①恒温恒容时,下列措施能使该反应速率增大的是(填字母)。
A.增加的浓度 B.选择高效催化剂 C.充入氦气 D.适当降低温度
②2min时,(填“>”、“<”或“=”),0~5min内,反应的平均速率
。
③画出的物质的量随反应时间变化的曲线。

①该电池放电时,被还原的物质是,电子从(填“b→a”或“a→b”)
②该电池的负极反应为。

由图中曲线变化可知,该反应为(填“放热”或“吸热”)反应,破坏旧键需要吸收的能量为(填“E1”、“E2”、“E1+E2”或“E2-E1”下同),破坏cmolC的化学键需要吸收的能量为。

该反应的化学方程式为:;
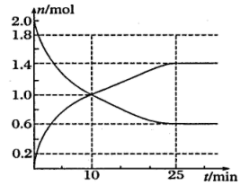
下列叙述不能判断该反应达到平衡状态的是;
①容器中压强不再改变; ②容器中气体密度不再改变;
③O2的物质的量浓度不再改变; ④SO3的质量不再改变;
下列说法错误的是
①电池放电时通入空气的电极为负极;
②电池放电时,电解质溶液的碱性逐渐减弱;
③电池放电时每消耗3.2gH2转移3.2mol电子。
 B .
B .  C .
C .  D .
D . 

