 氧气
B .
氧气
B .  水
C .
水
C .  氯化钠
D .
氯化钠
D .  金刚石
金刚石
选项 | 实验目的 | 实验方案 |
A | 鉴别CO和O2 | 将两种气体分别通入澄清石灰水 |
B | 除去粗盐中的CaCl2 | 将粗盐用足量水溶解,过滤 |
C | 测定溶液的pH | 将湿润的pH试纸浸入溶液中,取出,与标准比色卡对照 |
D | 制备O2 | 向装有少量MnO2的锥形瓶中慢慢加入稀H2O2溶液 |

选项 | 实验现象 | 解释 |
A | 将50mL水和50mL酒精混合,总体积小于100mL | 分子之间有空隙 |
B | 向锌粒中加入稀硫酸,产生气泡 | 金属均能与酸反应产生H2 |
C | 将黄铜片和铜片相互刻画,铜片表面有明显划痕 | 合金的硬度往往比其成分金属大 |
D | 铁丝在空气中不能燃烧,在氧气中可以燃烧 | 氧气的浓度对物质的燃烧有影响 |
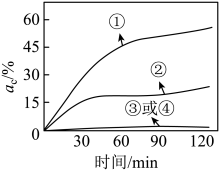
有机物DMF是一种水污染物,在疏松多孔Al2O3的催化下,O3先将其转化为小分子化合物,最终降解为CO2而去除。制备O3时,将O2通过臭氧发生器,O2部分转化为O3 , 得到O3与O2的混合气体。为研究Al2O3和O3对DMF的去除效果,取四份DMF溶液,控制其他条件相同,分别进行四个实验:①向溶液中通入O3与O2的混合气体并加入Al2O3;②向溶液中通入O3与O2的混合气体;③向溶液中加入Al2O3;④向溶液中通入O2并加入Al2O3。

①制作漆器使用的生漆中含有C21H32O2。C21H32O2中C、H、O元素的质量比为。
②朱漆由生漆和红色硫化汞(HgS)调和而成。Hg和硫磺(S8)加热化合可生成HgS,该反应的化学方程式为。朱漆经调和后,需透过细纱布,以除去其中较大的固体颗粒,该操作的名称为。
①新购的厨刀表面往往涂有一层油膜,目的是。
②厨刀的材质多为钢,钢属于(填序号)。
A.金属材料 B.合成材料 C.复合材料
③“文思豆腐”刀工精细、根根分明。豆腐中含有丰富的营养物质,其中含量较多的某有机物可转化为氨基酸,该有机物的名称为。
①扬州是唐代铸镜中心城市之一。制作唐镜的主要材料为铜锡铅合金,该合金比纯铜更易熔炼,原因是。
②唐镜表面有一层耐腐蚀的二氧化锡(SnO2)。SnO2是由SnO在空气中受热生成,该反应的化学方程式为。
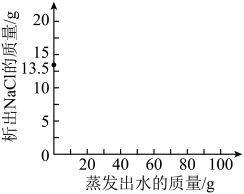
②取100g质量分数为13.5%的NaCl溶液,温度保持60℃,蒸发水分至NaCl完全析出。在图中画出析出NaCl的质量与蒸发出水质量的关系(已知60℃时NaCl的溶解度约为37g)。
②下列仪器中,制备并收集CO2时需选用的是(填序号),仪器E的名称为。

③下列干燥剂中,可用于干燥CO2的是(填序号)。
A.碱石灰 B.浓硫酸 C.氢氧化钠固体
气体 | CO2 | N2 | He |
体积分数/% | 17.65 | 27.15 | 23.84 |
三种气体中灭火效果最好的是(填化学式)。

①KHCO3灭火的原理较复杂。KHCO3受热分解时吸收能量,反应的化学方程式为。以初中所学燃烧和灭火的原理分析,KHCO3可用于灭火的原因有。
②向燃烧器内通入CH4和空气,点燃,待火焰稳定后,从进口A通入CO2 , 进口B加入KHCO3粉末。控制其他条件不变,测得火焰刚好熄灭时,KHCO3的用量与混合器中通入的CO2体积分数的关系如图—2所示。CO2体积分数在8%~10%内,随CO2体积分数的增加,使火焰熄灭所需的KHCO3用量不再减少,且燃烧器内残留的KHCO3增多,原因是。
①加入铁粉的目的是(用化学方程式表示)。过程中还会产生一种气体,其化学式为。
②过滤所得金属的成分是(填化学式)。
①加入Na2CO3溶液后,废水的pH(填“增大”“不变”或“减小”)。
②碱式碳酸铜有多种组成,可表示为Cu(OH)x(CO3)y , x和y需满足的关系式为。
③若反应温度过高,会生成一种黑色固体。该固体可能是(填化学式)。
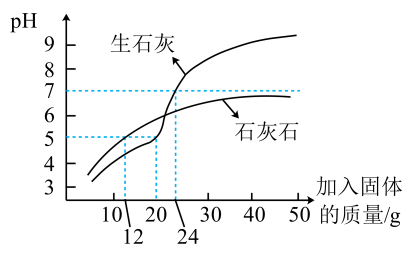
①生石灰与水反应的产物是(填化学式)。
②加入石灰石调节废水的pH,溶液的pH始终小于7,原因是。
③每吨生石灰的价格约为460元,每吨石灰石的价格约为130元。联合使用生石灰和石灰石,将这两种物质先后加入1L废水,调节废水的pH至约为7,经济效益较好的可行方案为。
①配制悬浊液时,保持温度不变,为使石膏充分分散在水中,可采取的措施是、。(填两点)
②制备时温度不宜过高,原因是。
③制备可看作是(NH4)2CO3与CaSO4发生复分解反应,(NH4)2CO3与CaSO4反应生成CaCO3的化学方程式为。理论上参加反应的CO2与NH3的质量比为。
④若石膏中CaSO4的质量分数为85%,取160g石膏进行反应,计算理论上可制得CaCO3的质量(写出计算过程)。

①两种吸附分别为离子对吸附和离子交换吸附。离子对吸附:球霰石表面的带负电,表面活性剂通过带正电的一端吸附于球霰石表面;离子交换吸附:球霰石表面的Ca2+带正电,表面活性剂中带正电的一端可取代球霰石表面的Ca2+ , 并吸附于球霰石表面。图—2中表示离子对吸附的是(填“A”或“B”)。
②有研究认为,球霰石转化为方解石经历了球霰石溶解、再沉淀为方解石的过程。表面活性剂能增加产物中球霰石的含量,原因是。