




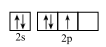
 C . NaOH的电子式:
C . NaOH的电子式: D . 1个
D . 1个 

研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
的立体构型为。

①X的化学式为。
②设X的最简式的式量为 ,晶体密度为
,则X中相邻K之间的最短距离为
(列出计算式,
为阿伏加德罗常数的值)。
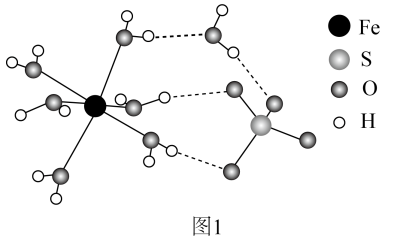
①的价层电子排布式为。
②中O和
中S均为
杂化,比较
中
键角和
中
键角的大小并解释原因。
③中
与
与
的作用力类型分别是。
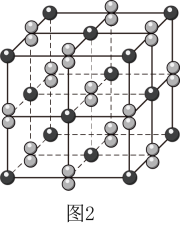
①距离最近的阴离子有个。
②的摩尔质量为
, 阿伏加德罗常数为
。
该晶体的密度为。
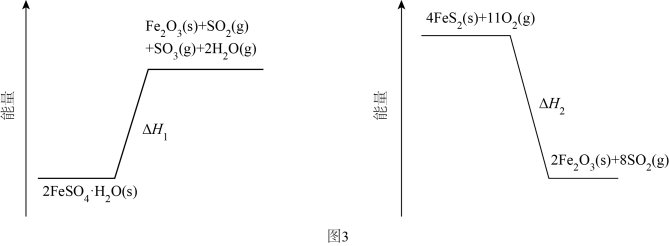
|
物质 |
|
|
|
|
熔点/℃ |
1700 |
x |
1238 |

A.范德华力 B.离子键 C.π键 D.σ键
a.非极性键 b.π键 c.离子键 d.氢键 e.配位键


①上述两种配合物都存在的化学键的是
a. 离子键 b. 配位键 c. 极性键 d. 非极性键。
②Ni(CO)4常温下难溶于水,易溶于CCl4中,可推知其为。(填“极性分子”或“非极性分子”)
③[Ni(NH3)6]SO4中阴离子的空间构型为。
①LiPF6各元素的第一电离能从大到小的顺序为。
②常见溶剂碳酸乙烯酯( ![]() )中碳原子的杂化方式是。
)中碳原子的杂化方式是。
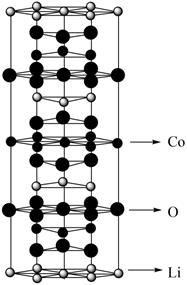
晶胞中含Li原子数为,若晶胞的底边边长为a nm,高为c nm,x:y:z=1:1:1,则LiNixCoyMnzO2晶胞的密度为g/cm3(列出计算式)。

①钆双胺分子中存在的化学键有。
A.离子键 B.氢键 C.配位键 D.共价键
②分子中C原子的杂化方式为。

①基态S原子的价电子排布式为。
②硫氧化钆(GOS)的化学式为。
③在下图的菱形框中补全该晶胞沿z轴方向的投影图。


①(填“>”、“=”或“<”)120°;从原子轨道重叠方式分类,分子中
键的类型是。
②气态时,测得甲酸的相对分子质量大于46,其原因可能是。
①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则的杂化轨道类型为(填标号)。
A. B.sp C.
D.
②的空间构型为;分子中的大π键可用符号
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
),则
中的大π键应表示为。




请回答下列问题:
①B的价电子层排布式为。
②Y的原子序数为39,其在元素周期表中的位置为。
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为。
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为,与该阴离子互为等电子体的离子为。

①LBO晶体化合物的化学式为。
②该晶体中含有的化学键有,晶体类型为,其中B采取杂化。
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=g·cm-3。(设阿伏加德罗常数的值为NA , 用含a、b、c、NA的代数式表示)

①该分子中Al原子采取杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有 (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
