
已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以
存在。
回答下列问题:
①Na2O②蔗糖③盐酸④Al(OH)3胶体⑤MgO⑥Cu2(OH)2CO3⑦空气 ⑧HNO3 ⑨NaClO3 ⑩Zn

请回答下列问题:
A. B.
C.
D.
加入氧化剂的目的是(用相应的离子方程式并加以文字说明)。
①上述反应的化学方程式为,其中盐酸表现出的性质是。
②有同学猜测铁与氯气反应可能还会生成氯化亚铁(假设铁已完全反应),该同学根据能否使酸性高锰酸钾溶液褪色来检验生成物中是否含氯化亚铁,你认为该同学的依据能否达到目的,并说明理由:。
③将8.7gMnO2与100g36.5%的盐酸充分反应后,再向溶液中加入足量的AgNO3溶液。若不考虑盐酸的挥发和氯气的溶解,则上述可制得的氯气是g,会得到g白色沉淀。
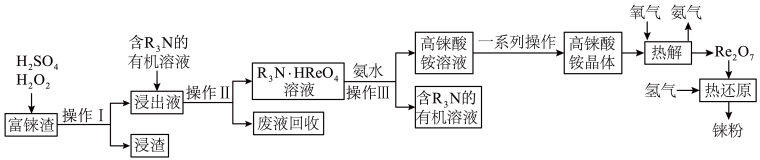

Ⅰ.在碱性条件下,利用NaClO氧化Fe (NO3) 3制得Na2FeO4:
3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4 +3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4 , 主要的生产流程如下:

①写出反应①的离子方程式。
②请写出生产流程中“转化”(反应③)的化学方程式。
③该反应是在低温下进行的,说明此温度下Kap(K2FeO4)Kap(Na2FeO4)(填“>” “<”或“=”)。
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液。
A.H2O
B.CH3COONa、异丙醇
C.NH4Cl、异丙醇
D.Fe(NO3)3、异丙醇

①若向pH= 10的这种溶液中加硫酸至1pH=2,的分布分数的变化情况是
②若向pH= 6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,转化为。(填化学式)
①除杂试剂为(填化学式),离子方程式为;
②除杂试剂为(填化学式),离子方程式为。
| B | C | N | O | F |
| Al | Si | P | S | Cl |
| Ga | Ge | As | Se | Br |
| In | Sn | Sb | Te | I |
| Tl | Pb | Bi | Po | At |
镓(Ga)在元素周期表中的位置为。

①“热转化”时Ga转化为GaN的化学方程式是。
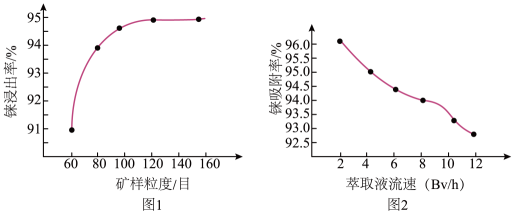
②“酸浸”操作的目的是。
①下列事实不能用元素周期律解释的 (填字母)。
a.碱性: b.非金属性:As>Ga
c.酸性: d.热稳定性:
用原子结构理论推测,GaAs中As元素的化合价为。
②废弃含GaAs的半导体材料可以用浓硝酸溶解,主要产物为、
和
, 写出该反应的化学方程式。
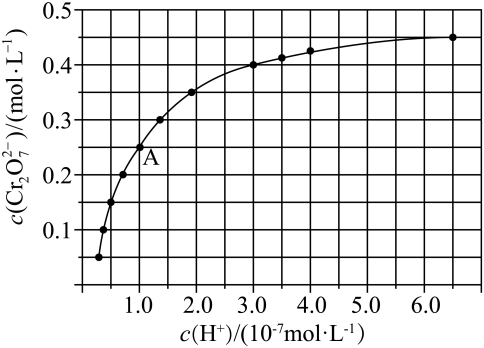
①由图可知,溶液酸性增大,的平衡转化率(填“增大“减小”或“不变”)。
②据A点数据,计算出该转化反应的平衡常数。
③初始浓度为的
溶液中加入一定量的硝酸至溶液的
, 则溶液由转变到(填溶液颜色)。

已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
①补全过程II中发生反应的离子方程式:
□□
□_=□
□_
□
_。
②除外,过程II中还可能生成一种含铁元素的难溶性杂质,该物质的化学式为。

已知:① +2H+=
+H2O。②NH4VO3微溶于冷水,易溶于热水,难溶于乙醇。回答下列问题:

已知:I.放电时负极的电极反应式为KxC6-xe-=C6+xK+;
Ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38 , 当溶液中某离子浓度低于1×10-5mol•L-1时,认为该离子已沉淀完全。
回答下列问题:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②能与Ce4+、Al3+结合成稳定的CeF3+、
, 这有利于酸浸步骤,不利于后续的沉淀步骤。
③溶液中铈的常见离子有Ce4+、Ce3+ , 其中Ce4+能被萃取剂TBP萃取,而Ce3+不能被萃取。
回答下列问题:

H2CO3 | Ce2(CO3)3 | |
