 B .
B .  C .
C .  D .
D . 
 B . 过滤
B . 过滤 C . 稀释浓硫酸
C . 稀释浓硫酸 D . 量取9.3mL液体
D . 量取9.3mL液体
|
|
|
|
|

 向少量pH=3的硫酸溶液中不断加水
B .
向少量pH=3的硫酸溶液中不断加水
B .  室温下,将少量的氧化钙加入足量的饱和氢氧化钙溶液中
C .
室温下,将少量的氧化钙加入足量的饱和氢氧化钙溶液中
C . 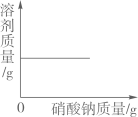 在一定温度下,向一定质量的硝酸钾饱和溶液中不断加入硝酸钠晶体
D .
在一定温度下,向一定质量的硝酸钾饱和溶液中不断加入硝酸钠晶体
D .  分别向盛有等质量的镁和氧化镁的烧杯中逐渐加入足量等溶质质量分数的稀盐酸
分别向盛有等质量的镁和氧化镁的烧杯中逐渐加入足量等溶质质量分数的稀盐酸
选项 | 实验目的 | 操作方法 |
A | 鉴别涤纶纤维和羊毛纤雄 | 分别取样、灼烧,闻气味 |
B | 分离氯化钠和碳酸钙的固体混合物 | 加入足量的稀盐酸,蒸发 |
C | 除去锌粉中的少量铁粉 | 加入足量硫酸亚铁溶液,过滤 |
D | 鉴别甲烷和氢气 | 分别点燃,并在火焰上方罩上干冷烧杯 |
Ⅰ、取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体质量随加入水的质量的变化情况如图1所示;
Ⅱ、取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ、继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化情况如图2所示。
下列推测正确的是( )


①干冰②碳酸氢钠③熟石灰④大理石⑤酒精⑥糖类
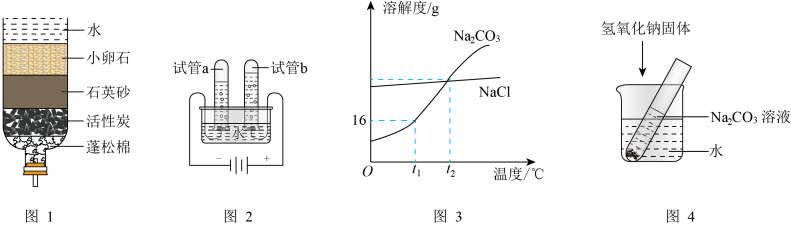
①在t1℃时,Na2CO3的溶解度为g。
②在t1℃时,5gNa2CO3固体加入试管,再向试管中加入25g水充分振荡后,所得溶液的质量为g。然后将试管放在盛有水的烧杯中,向烧杯中加入氢氧化钠固体(如图4所示)。发现试管内的Na2CO3固体逐渐溶解,请结合溶解度曲线说明理由:。

“二锅头酒”受许多爱酒者的喜爱,其开始生产距今有800多年的历史,“二锅头”酿造的主要过程为:原料粉碎——拌料——发酵——混蒸混烧——摘酒——贮存,其名字的由来就出现在“混蒸泥烧”这一步。
图1为古代烧酒蒸馏设备示意图。天锅用于冷却,一般要换三次凉水才能蒸完一甑酒。第一锅酒中甲醇、醛类较多,口感暴辣;第三锅酒中高级醇和酸类较多、酯类少,酸味大、寡淡不香;第二锅酒精香馥郁,醇厚甘爽,质量最好。所以,蒸馏时掐头去尾留第二锅,顾名“二锅头”。细菌是酒发酵过程中不可或缺的,某酒厂对发酵过程中细菌的结构和温度的变化进行了研究,结果如图2所示,新蒸出的“二锅头”经过贮存可使口感更加绵柔,主要原因是贮存时微量成分的含量发生变化,使酒体达到各香味成分的动态平衡。

依据上述材料信息,回答下列问题。
a.“二锅头”是指蒸一甑酒冷却流出的第二锅酒
b.贮存可使酒体达到各香味成分的动态平衡
c.“二锅头”中的主要溶质是乙醇,乙醇是有机物
d.第一锅酒口盛暴辣的原因是酒中甲醇,醛类较多

通过观察颜色,可以鉴别出的物质是。
步骤 | 实验操作 | 现象 | 结论 |
① | 分别取少量剩余4种物质于试管中, 向试管中加入少量水,振荡,观察 | 该物质为生石灰 | |
② | 另分别取还未鉴别出的3种固体 物质于试管中,加水充分溶解, 再分别加入氢氧化钡溶液 | 其中一支试管内没 观察到明显现象 | 该试管内原物 质为 |
实验结束时发现,步骤①的试管底部残留有白色不溶物。同学们猜想该生石灰可能变质并探究该白色不溶物的组成,设计了如下实验。
实验操作 | 现象 | 结论 |
向试管中再加入少量水, 振荡,静置,观察 | 仍有固体剩余 | 生石灰已经部分变质, 含有CaCO3和Ca(OH)2 |
向上层清液中加无色 酚酞,现察 | 酚酞变红 |
小智同学对该结论提出异议,理由是生石灰与水反应也会生成Ca(OH)2 , 化学方程式为。常温下Ca(OH)2微溶于水,不能说明剩余固体为CaCO3。小组同学再次设计了如下实验:

打开K1 , 缓慢将注射器中的水全部推入三颈瓶后关闭K1 , 打开K2 , 然后再缓慢将注射器中的稀盐酸推入三颈瓶,直至观察到没有气泡产生时,关闭K2。测得三颈瓶内气体中的体积分数(%)随时间的变化情况如图乙所示。a~b段
的体积分数变化不明显的原因是。

查阅资料:熟石灰在一定条件下会分解:Ca(OH)2CaO+H2O↑。
①向如图A装置的试管中加入mg生石灰样品,加热。可根据实验前后装置(填字母序号)的质量变化,判断生石灰样品中含有Ca(OH)2。
实验结论:生石灰样品的成分为CaO、CaCO3、Ca(OH)2。
②若用该装置测定生石灰样品中各成分的含量,兴趣小组对可能存在的问题进行分析,下列说法正确的是(填字母序号)。
a.空气不会影响测量结果
b.反应后各装置中残留的气体会导致测量误差
c.反应生成的水蒸气因冷凝回流可能使试管炸裂
d.实验结束后B中的液体可能会倒吸到A中