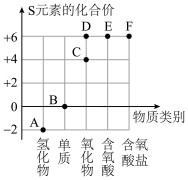
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
③金属铝与盐酸反应生成AICl3和H2 , 所以金属铁与盐酸反应生成FeCl3和H2
④浓盐酸试剂瓶敞口久置后变稀且质量减轻,所以浓硫酸敞口久置也变稀且质量减轻
①C→CO→CO2 ②Al→Al2O3→AlCl3 ③Na2CO3→NaCl→NaNO3
④CaCO3→CaO→Ca(OH)2
| 组别 | 实验目的 | 实验设计 |
| A | 除去FeCl3溶液中混有的少量CuCl2 | 加入过量的铁粉,过滤 |
| B | 分离铜粉和镁粉的混合物 | 加入足量的稀HCl,过滤、洗涤、干燥 |
| C | 提纯混有少量Ca(OH)2的NaOH溶液 | 加入过量的Na2CO3溶液,振荡、静置、过滤 |
| D | 鉴别Na2CO3、BaCl2、NaCl溶液 | 取样后,分别滴加稀H2SO4溶液,观察现象 |
 为用浓硫酸配制稀硫酸
B .
为用浓硫酸配制稀硫酸
B .  测得的氧气的体积偏小
D .
测得的氧气的体积偏小
D .  可比较Al和Fe的金属活动性
可比较Al和Fe的金属活动性
 B .
B .  C .
C .  D .
D . 


|
铁丝 |
铜丝 |
铁丝 |
铜丝 |
|
稀硫酸 |
-稀硫酸 |
硫酸铜溶液 |
硝酸银溶液 |
|
① |
② |
③ |
④ |




【方案】取四支试管编号为①、②、③、④,分别作如图处理,两周后,观察铁钉表面的锈蚀情况。
【分析】
【解释】根据以上实验,请解释学校铁栅栏涂漆能防锈的原因是:。
|
实验编号 |
双氧水质量 |
加入固体物质 |
产生气体的体积 |
耗时 |
结束后固体质量(滤出后烘干) |
|
1 |
100g |
/ |
32mL |
380S |
/ |
|
2 |
100g |
0.2g二氧化锰 |
32mL |
36.5S |
0.2g |
|
3 |
100g |
0.2g氧化铁 |
32mL |
89.5S |
0.2g |
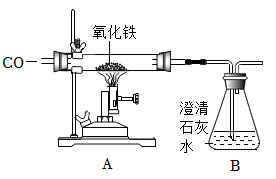
![]()
查阅资料发现该方法在实际生产中应用不广,请结合参考资料分析原因;
如图所示为氢气还原氧化铜的装置,甲中锥形瓶内装有锌粒,分液漏斗里装有稀硫酸,乙中盛有浓硫酸,丙中试管底部黑色固体为氧化铜。
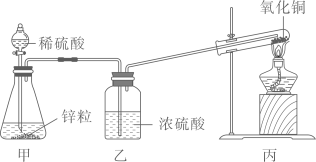
开始反应时,先打开甲处分液漏斗活塞,反应一段时间后再点燃丙处的酒精灯,这样操作的目的是;


|
实验操作 |
实验现象 |
实验结论 |
|
|
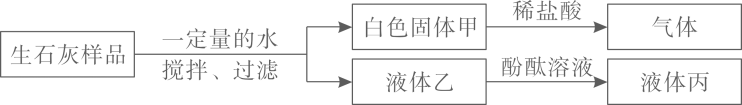
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液 |
有白色沉淀生成 |
滤液中的溶质是 |
|
|
步骤2:静置,向上层清液中滴加无色酚酞溶液 |
溶液变红 |
||

求:
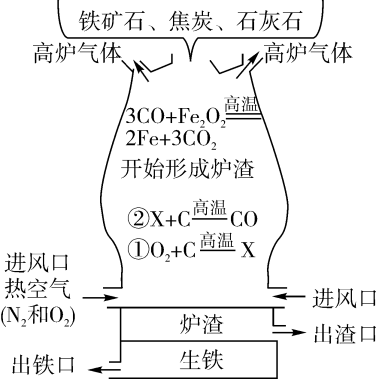
小明对反应产物的变化情况进行了如下探究:利用图甲所示实验装置,称取若干份质量均为0.60克的氧化铜,在相同条件下分别用氢气还原不同时间并检测固体中氧化亚铜的质量。


①向少量废液中滴加石蕊试液,试液变红色。
②向10mL废液中滴加Na2CO3溶液,测得沉淀总质量与加入的Na2CO3溶液总质量的关系如下表所示:
|
第一次测量 |
第二次测量 |
第三次测量 |
第四次测量 |
|
|
加入Na2CO3溶液的总质量/g |
10 |
20 |
30 |
40 |
|
生成沉淀总质量/g |
a |
0.5 |
1.5 |
2 |