
选项 | A | B | C | D |
反应装置 |
|
|
|
|
实验现象 | 反应开始后,针筒活塞向右移动 | 稀释时烧杯壁温度明显升高 | U形管的液面左高右低 | 温度计的水银柱不断上升 |
| 实验序号 | 起始温度 | 终止温度 | 温度差 | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25.4 | 25.0 | 25.2 | 28.5 | 3.3 |
| 2 | 24.5 | 24.5 | 24.5 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
已知:中和后生成的溶液的比热容为 , 该实验条件下,中和热的理论值为
。下列说法正确的是( )
①混合气体中的物质的量为
。
②将完全燃烧后所得的通入
溶液中,完全反应后所得溶液中的溶质为(填化学式,不考虑气体逸出)。
③已知:。则M完全燃烧生成
和
所放出的热量为。
①上述变化属于(填“物理”或“化学”)变化。
②常温常压下,石墨与金刚石更稳定的是。


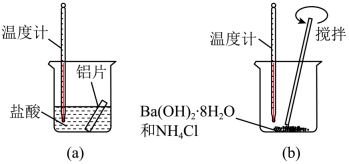
①上述三套装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是,说明该反应属于(填“吸热”或“放热”)反应。

a.可用如图所示装置测定中和热
b.若将环形玻璃搅拌棒换成铜丝,测定的△H偏低
c.若2种溶液的体积均改为60mL,测定的△H偏高
d.若将盐酸改为醋酸,测定的△H偏高
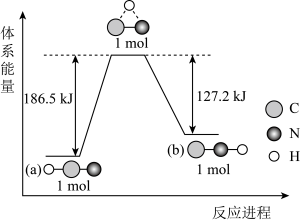
①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是热反应,(b)中温度降低,由此可以判断(b)中反应是热反应。
②写出铝与盐酸反应的离子方程式:。
③根据能量守恒定律,(b)中反应物的总能量应该(填“高于”或“低于”)其生成物的总能量。

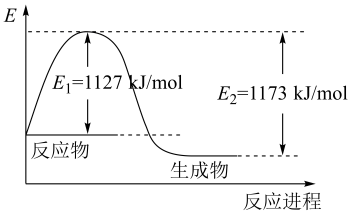
①化学键断裂需要(填“释放”或“吸收”)能量。
②图中共释放的能量为kJ。
③该反应的反应物的总能量(填“大于”、“等于”或“小于”)生成物的总能量,所以该反应是反应。
化学键 | A≡A | B-B |
键能(kJ/mol) | 946 | 436 |

①从实验装置上看,图中缺少的一种玻璃仪器是。烧杯间填满碎纸条的作用是。若大烧杯上不盖硬纸板,求得的中和热ΔH (填“偏大”“偏小”或“无影响”)。
②甲同学用50 mL 0.50 mol·L-1盐酸与 50 mL 0.55 mol·L-1 NaOH溶液进行中和反应,通过计算得到ΔH=-54.8kJ/mol,该结果与ΔH=-57.3kJ·mol-1有偏差,产生此偏差的原因可能是。
A、用温度计测定HCl溶液起始温度后直接测定NaOH溶液的温度
B、一次性把NaOH溶液倒入盛有硫酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用 60 mL 0.50 mol·L-1盐酸与 60 mL 0.55 mol·L-1 NaOH溶液进行反应,两个实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)若用50mL0.5mol·L-1醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会(填“偏大”、“偏小”或“不受影响”)。