反应Ⅰ:Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH1>0
反应Ⅱ:Fe3O4(s)+4CO(g) = 3Fe(s)+4CO2(g) ΔH2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO
的体积分数随温度的变化关系如图所示。下列说法正确的是
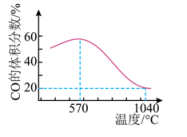 ( )
( )
压强p/Pa | ||||
0.08 | 0.20 | 0.40 | 0.80 |
下列说法一定正确的是
选项 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
② | 25 | 5 | 0.1 | 10 | 0.1 | X |
③ | 50 | 10 | 0.1 | 5 | 0.2 | 5 |

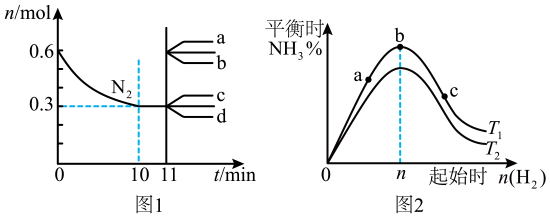
时间 | 0 | 1 | 2 | 3 | …… |
| 3.60 | 3.05 | 2.85 | 2.76 | …… |
用的浓度变化表示
的平均反应速率为
。
实验编号 | 实验目的 | | 同种催化剂的比表面积 | 一段时间内的平均速率/ |
Ⅰ | 对照实验 | 280 | 80 | |
Ⅱ | 研究催化剂比表面积对尾气转化速率的影响 | a | 120 | |
Ⅲ | b | c | d | |
【实验分析与结论】
①补全表格a.,b.,c.,d.。
②测得 , 对比实验Ⅰ、Ⅱ,可得结论:。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是。

①石英坩埚 ②瓷坩埚 ③铁坩埚
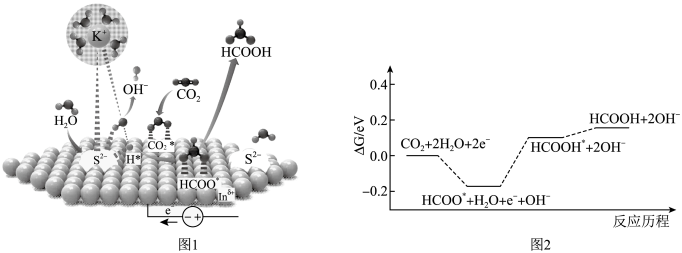
①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2 , 使K2MnO4歧化为KMnO4和MnO2 , 过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
过程②向滤液中通入足量CO2 , 可观察到的现象为;检验K2MnO4歧化完全的实验方法是。
| 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| H2C2O4溶液 | KMnO4溶液 | 3mol/L稀硫酸 | |||
| 1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
| 2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
| 3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
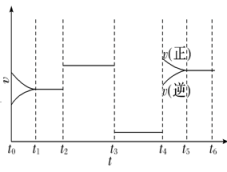
2A(g)+B(g)3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
①t3时改变的条件为,t4时改变的条件为。
②a(填“>”或“<”)0。


则用焦炭还原NO生成无污染气体的热化学方程式为。
0min | 5min | 10min | 15min | 20min | |
2.00 | 1.70 | 1.56 | 1.50 | 1.50 | |
0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是。
A.气体的颜色不再变化 B.CO的反应速率为N2的4倍
C.混合气的压强不再变化 D.化学平衡常数K不再变化
③在20min时,保持温度不变,继续向容器中再加入1.0molNO2和1.0molN2 , 则化学平衡移动(填“正向”、“逆向”或“不”)。

在T℃、1100KPa时,该反应的化学平衡常数(用平衡分压代替平衡浓度,气体分压=气体总压×体积分数;保留两位小数)。
如CO2可与H2生成CH4:CO2(g)+4H2(g)CH4(g)+2H2O(g)。

下列说法错误的是____。(单选)


①、②与过渡态三种物质中,最不稳定的是;①转化为②过程中(选填“吸收”或“放出”)能量。
CO2 (g) + 3H2(g)CH3OH(g) + H2O (g)

若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率 ʋ =。
①CO2 (g) +H2(g) CO(g) + H2O (g) ②CO(g) +2H2(g)
CH3OH(g)
上述反应过程中能量变化可用如图表示,

其中反应为慢反应(填“①”或“②”)。对反应②自发性的判断正确的是(单选),判断依据是。
A.高温下自发 B.低温下自发 C.始终自发 D.始终不自发