|
A |
B |
C |
D |
|
|
|
|
|
|
制备氢氧化铁胶体 |
比较卤素单质氧化性强弱 |
洗气除去SO2中的CO2 |
测浓硫酸的pH |
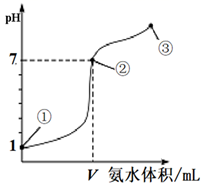
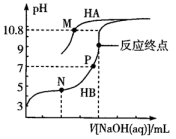
已知:M点溶液中c(A-)=c(HA)

下列说法正确的是
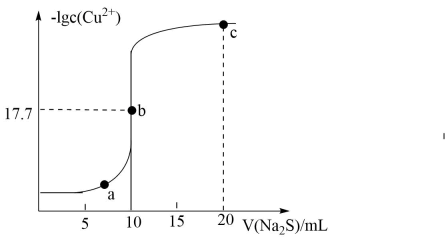

若要检验是否变质生成了
, 所用的试剂是。
H2C2O4 | H2CO3 | HNO2 |
Ka1=5.6×10-2 Ka2=1.5×10-4 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=5.6×10-4 |
回答下列问题:
滴定次数 | 滴定前酸性KMnO4溶液的读数/mL | 滴定后酸性KMnO4溶液的读数/mL |
1 | 0.10 | 20.30 |
2 | 0.50 | 20.80 |
3 | 0.00 | 22.00 |
4 | 1.10 | 21.20 |
①KMnO4溶液应盛装在(填“酸式”或“碱式”)滴定管中,原因为。
②达到滴定终点时的标志为。
③c(H2C2O4)= mol∙L-1。

①由图可知,溶液减小,
的平衡转化率(填“增大”“减小”或“不变”)。根据A点数据,计算出反应A的平衡常数为。
②升高温度,溶液中的平衡转化率减小;则反应A的
(填“>”或“<”)0。
③向酸性溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由。
④向酸性溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明
浓度的减小使得反应A的平衡逆向移动,理由是:。
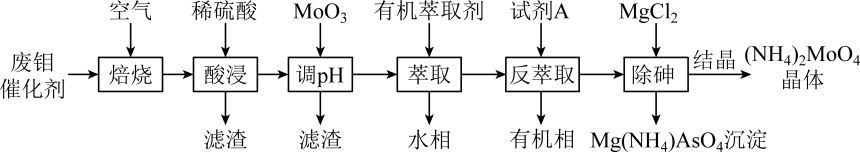
注:酸浸后钼元素以MoO形式存在。
回答下列问题:
已知:溶液中某离子浓度≤10-5mol•L-1时,认为沉淀完全;常温下Ksp[Fe(OH)3]=10-38.5 , Ksp[Cu(OH)2]=10-19.6。
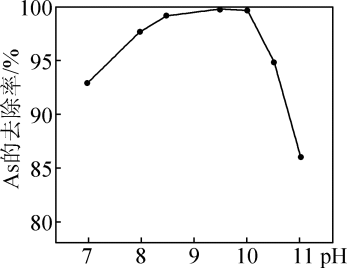
已知:(NH4)3H4PMo12O42•H2O+26NaOH=12Na2MoO4+Na2HPO4+3NH3↑+17H2O。
Zn2++2Fe2++3C2O+6H2O
ZnFe2(C2O4)3·6H2O↓
ZnFe2(C2O4)3·6H2O……
某兴趣小组按下列流程制备ZnFe2O4。
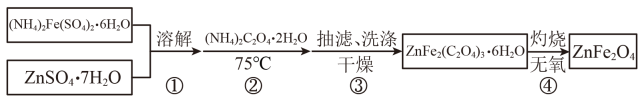
请回答:
a.烧杯 b.坩埚 c.蒸发皿 d.马弗炉 e.表面皿
完成灼烧得到产品的化学方程式是。
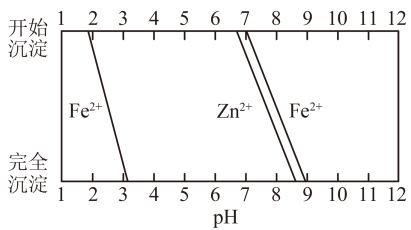
从以下选择合适步骤并填空;d→→→→i→→→e;
a.加入新制氯水;
b.锌皮完全溶于稍过量的3 mol·L-1稀硫酸;
c.加入30%H2O2;
d.锌皮用热碱洗涤干净;
e.过滤、洗涤、干燥;
f.过滤得ZnSO4溶液;
g.加入纯ZnO粉末;
h.蒸发浓缩,冷却结晶;
i.加热到60℃左右,并不断搅拌;
其中步骤i中加热的主要目的是:。