| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
 D .
D . 



 B . 闻气体气味
B . 闻气体气味 C . 干燥氢气
C . 干燥氢气 D . 移走蒸发皿
D . 移走蒸发皿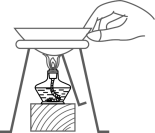
 B .
B .  C .
C . 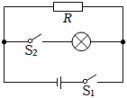 D .
D . 
 挺举杠铃的过程
B .
挺举杠铃的过程
B .  滑动船浆的过程
C .
滑动船浆的过程
C .  抛出篮球后的过程
D .
抛出篮球后的过程
D .  将弓拉弯的过程
将弓拉弯的过程
| 选项 | 实验目的 | 实验方案 |
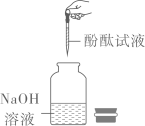
| A | 检验氢氧化钠是否变质 | 溶于水,滴加酚酞试液 |
| B | 检验氧气已经集满 | 将带火星的木条伸入集气瓶中,观察现象 |
| C | 鉴别氢气和甲烷 | 分别点燃,在火焰上方罩干冷的烧杯 |
| D | 除去氮气中混有的少量氧气 | 通过灼热的铜粉 |





①“捕捉”二氧化碳:高压条件下将废气中的二氧化碳溶解于甲醇,得到二氧化碳的甲醇溶液。所得溶液中溶质是(填化学式)。
②生产甲醇:用捕捉到的二氧化碳和氢气混合,一定条件下可以反应生成甲醇和一种氧化物(H2+CO2→CH3OH+X):下列说法正确的是(填字母序号)
A.X为水分子 B.该反应体现了无机物在一定条件下可以转化为有机物
C.反应前后分子数目不发生改变 D.该反应为氧化还原反应



甲:KCl、K2CO3、CaCl2乙:KNO3、Ca(NO3)2、KCl
| 序号 | 评价标准 | 分值 |
| 1 | 营养液中含N、P、K元素,每一种可加1分(同种只加1分) | 3分 |
| 2 | 组内物质均能共存,不发生化学反应,发生一个扣1分 | 2分 |

【查阅资料】]①铝热剂是铝粉和难熔金属氧化物的混合物,最常见的组合是铁铝热剂;
②铝可以与氢氧化钠溶液反应,反应过程中有氢气生成;
③铝热反应能得到新的金属单质和金属氧化物;
④四氧化三铁能被磁铁吸引,氧化铁和氧化亚铁均不能被磁铁吸引。
【提出问题】铁铝热剂中铁的氧化物是什么?
【作出猜想】甲:Fe2O3;乙:Fe3O4;丙:Fe2O3、Fe3O4。
【实验探究】
实验操作 | 实验现象 | |
步骤1:取一定量的样品于试管中,加入足量氢氧化钠溶液 | 产生气泡,部分固体溶解 | 铁的氧化物为Fe2O3 |
步骤2:将步骤1中反应后的混合物过滤,取少量烘干后的滤渣研碎,用磁铁充分吸引 | 滤渣不能被吸引 |
【讨论交流】步骤1中加入足量氢氧化钠溶液,而不加稀盐酸或稀硫酸的目的是。
【质疑】有同学认为上述实验结论不严谨,铝热剂中可能还含有FeO。于是设计图1所示的装置,进一步探究验证铁的氧化物(实验前先通入一段时间氮气,排净装置内的空气)。
【数据记录与处理】取步骤2中的滤渣mg在A装置中充分应后,测A装置中的质量。如果铁铝热剂中铁的氧化物只有Fe2O3;则置A将减少g(用含m的式子表示)
【拓展迁移】
⑴铝热剂样品在高温下发生铝热反应,其反应化学方程式为
⑵铝热反应实验装置如图2所示,实验时点燃镁条,镁条剧烈燃烧,放出大量热;纸漏斗下部被烧穿,有熔融物落入沙中。其中氯酸钾的作用是。


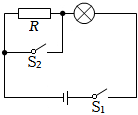
| 动力F1/N | 动力臂l1/m | 阻力F2/N | 阻力臂l2/m | F1l1/N·m | F2l2/N·m |
| 0.2 | 0.02 | 0.1 | 0.04 | 0.004 | 0.004 |
A.仍然水平平衡 B.左端下沉 C.右端下沉 D.无法确定

测量 次数 | 物重 G/N | 斜面 高h/m | 沿斜面的 拉力F/N | 斜面长 s/m | 有用功 W有/J | 总功 W总/J | 机械效率η |
1 | 1.5 | 0.1 | 0.6 | 0.4 | 0.15 | 0.24 | 62.5% |
2 | 3 | 0.1 | 1.2 | 0.4 | 0.3 | 0.3 | 62.5% |
3 | 6 | 0.1 | 2.4 | 0.4 | 0.4 | 0.6 | 62.5% |

I、打开弹簧夹,通入一段时间的氮气;
II、关闭弹簧夹,给碳酸氢样品加热;
III、当样品反应完全,......,再停止加热,直到玻璃管冷却;
IV、实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:


| 测量次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入稀盐酸的总质量(g) | 10 | 20 | 30 | 40 | 50 |
| 烧杯总质量(g) | 25.56 | 35.12 | 44.68 | 54.24 | 64.24 |