| 硫酸化学纯(CP) (500 mL) 化学式:H2SO4 相对分子质量:98 质量分数:98% 密度:1.84 g/mL |
所含离子 | M | |||
浓度(mol/L) | 4 | 2 | c | 6 |
|
5%葡萄糖注射液500 mL [性状]本品为无色或几乎无色的透明液体,味甜。 [规格]500 mL,25 g [贮藏]密闭保存。 |
属于电解质的是,属于非电解质的是能导电的是 。

其中I为化合反应,IV是反应。


 称量
B .
称量
B .  溶解
C .
溶解
C .  转移溶液
D .
转移溶液
D . 

①向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液()
②向AgNO3溶液通入少量HCl()
③向氨水中通入HCl直至过量()
④向饱和石灰水中不断通入CO2()



①Na2SO3的电离方程式是。
②下列反应中,能用同一离子方程式表示的是(填序号)。
A.Ca(OH)2溶液与稀CH3COOH B.NaOH和稀H2SO4
C.Ca(OH)2溶液与稀HNO3 D.NaOH和稀盐酸
③过程I的离子方程式是 。
④过程Ⅱ中反应的化学方程式是 。
⑤双碱法脱硫过程中,循环利用的物质是(填化学式)
该电池消耗6.6gCO2时,消耗标准状况下CO2的体积是 L,其中含氧原子个(已知阿伏加德罗常数的数值为NA)
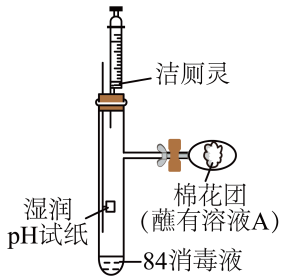
【产品名称】84消毒液 【有效成分】NaClO 【规格】1000mL 【物质的量浓度】4.0 注:①按一定比例稀释后使用 ②不得与酸性产品(如洁厕灵)同时使用。 |
①配制过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、、。
②配制时,需要取用mL“84消毒液”原液。
③下列操作会使溶液中NaClO浓度偏低的是。
A.取用的“84消毒液”原液是久置的
B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线