 B . 禁止带火种
B . 禁止带火种 C . 可回收塑料
C . 可回收塑料 D . 节约用水
D . 节约用水
 点燃酒精灯
B .
点燃酒精灯
B .  倾倒液体
C .
倾倒液体
C .  连接仪器
D .
连接仪器
D .  熄灭酒精灯
熄灭酒精灯


选项 | 操作 | 现象 | 结论 |
A | 向红墨水中加入活性炭 | 红色褪去 | 活性炭具有还原性 |
B | 向灼热的CuO中通入CO | 红色粉末变成黑色 | CO具有还原性 |
C | 向过氧化氢溶液中加入二氧化锰 | 快速产生大量气泡 | 二氧化锰能提高O2的产量 |
D | 向稀硫酸中加入锌粒 | 锌粒表面产生气泡,且速率适中 | 实验室可用该反应制氢气 |
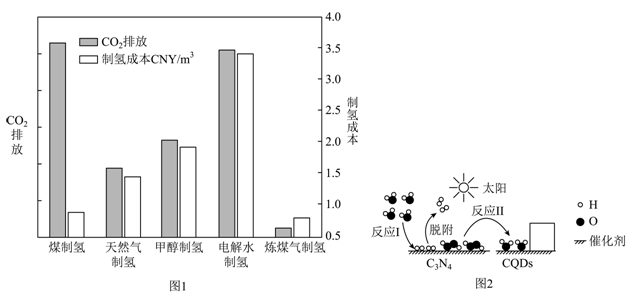
①“灰氢”制取过程中,会导致的环境问题是。
②结合图1分析,电解水制氢尚未普及的主要原因是。
①使用纳米CaO的吸附效果优于微米CaO的原因是。
②碳捕获所得高浓度的二氧化碳可用于(举一例用途)。
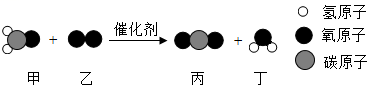
①反应1、II前后没有改变的粒子是(写化学符号)。写出图中方框内粒子的化学式:。
②反应Ⅱ的化学方程式为。

I、绿色锈迹是碱式碳酸铜【Cu2(OH)2CO3】,受热易分解。
Ⅱ、无水硫酸铜为白色粉末,遇水变蓝。
Ⅲ、氧化铜与稀硫酸反应生成硫酸铜(CuSO4)和水,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【开展实验】该同学将少量碱式碳酸铜放入试管中加热,观察到试管中的固体由绿色变成黑色,试管壁上有无色液滴生成。
【提出问题】碱式碳酸铜受热分解产物是什么?
【猜想与探究】
实验操作 | 现象 | 结论与解释 |
将少量黑色固体放入试管中, 加入足量稀硫酸,充分振荡 | 黑色固体全部 溶解 | 猜想②正确 补充完成反应化学方程式: |

①实验步骤:
步骤一:依次连接装置A→(填“B→C”或“C→B”)。
步骤二:打开活塞,通入一段时间的氮气,目的是。
步骤三:关闭活塞,点燃酒精灯加热A,观察到明显现象后,停止加热。
②证明碱式碳酸铜受热分解生成了H2O的主要现象是装置C;当装置B中出现的现象,可以证明碱式碳酸铜受热分解生成了CO2 , 装置B中反应的化学方程式。

【实验】他用电子天平称取0.49gFe2O3和一定量的KClO3 , 充分混合后加热至KClO3完全分解,冷却至室温,称得剩余固体的质量为1.98g。
(化学方程式为:)
【计算】
剩余固体中KCl的质量是g。
【探究】
他调节KClO3和Fe2O3的质量比制备O2 , 整理数据绘制出如图,从图中得出KClO3和Fe2O3的最佳质量比是。

为了获得最快的反应速度,请你计算出小金同学在【实验】中称取的Fe2O3的最佳质量应为g。