实验 | 操作方法或解释 | |
A | 用量筒量取液体 | 视线与液体凹液面的最低处齐平 |
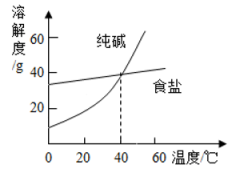
B | 软化硬水 | 煮沸或蒸馏 |
C | 除去 MnO2 中少量 KCl | 溶解→过滤→洗涤→干燥 |
D | 将 3000L 氧气压缩到 20L 的钢瓶中 | 因为分子变小了 |

|
|
|
|
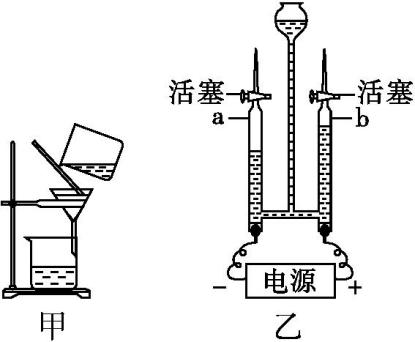
A.验证质量守恒定律 | B.探究灭火的原理之一 | C.用于测定空气中O2的含量 | D.海水从b口进入净化后可得纯净水 |
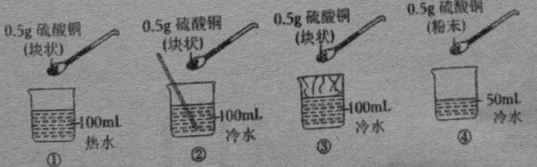



a.用玻璃棒引流 b.滤纸边缘高出漏斗
c.漏斗末端未紧靠烧杯内壁
d.将滤纸用水润湿,使其紧贴漏斗内壁
作用。

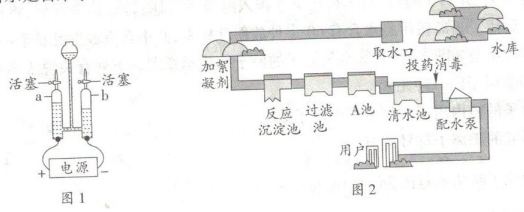
①图中A池需要除去色素和异味,加入的物质是,利用其性。
②硬水会对我们的生产生活造成危害,生活中常用的方法来降低水的硬度。
③水是一切生命体生存所必需的物质,为了人类的生存和发展,人类必须爱护水资源,一方面要节约用水,另一方面要。
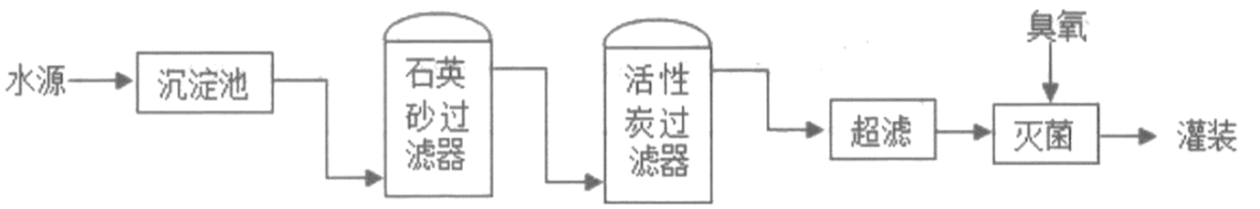
①难溶性大颗粒 ②可溶性金属离子 ③可溶性大分子和大分子团
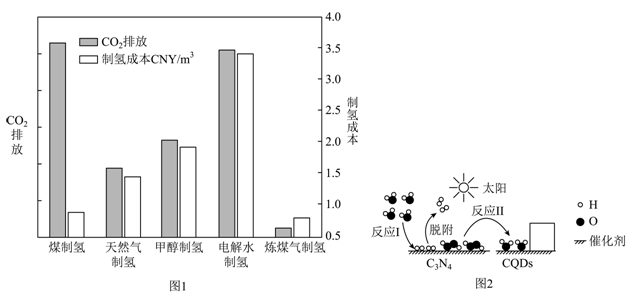
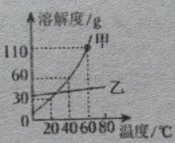
①“灰氢”制取过程中,会导致的环境问题是。
②结合图1分析,电解水制氢尚未普及的主要原因是。
①使用纳米CaO的吸附效果优于微米CaO的原因是。
②碳捕获所得高浓度的二氧化碳可用于(举一例用途)。
①反应1、II前后没有改变的粒子是(写化学符号)。写出图中方框内粒子的化学式:。
②反应Ⅱ的化学方程式为。
[提出问题] 该干燥剂的成分有哪些?
[查阅资料] ①碳酸钙在900 ℃以上时会分解生成氧化钙和二氧化碳;②氢氧化钙在500 ℃以上会分解生成氧化钙和水。
实验步骤 | 实验现象 | 实验结论 |
①取少量该干燥剂样品于试管中,加入一定量的水 | 该干燥剂样品中一定有氧化钙 | |
②取①中上层清液于试管中,滴加酚酞溶液 | 溶液变红 | 该干燥剂样品中一定有 |
③另取少量干燥剂样品于试管中,滴加足量稀盐酸 | 该干燥剂样品中一定有碳酸钙 |
为了进一步探究干燥剂中是否有氢氧化钙,小红称取该干燥剂m1 g,加热至固体质量不再变化,称量反应后固体质量为m2 g,加热温度应控制的范围是,若m1(填“>”“<”或“=”)m2 , 说明该干燥剂中含有氢氧化钙。

[查阅资料]
①在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是电解质,在溶液中都能电离出离子。
②复分解反应的实质是电解质在溶液中发生离子间的互换后,使某些离子的浓度迅速减小,反应向减小离子浓度的方向进行。如果离子混合后,离子浓度不发生变化,那就没有发生反应。
[提出问题]复分解反应发生的条件是什么?
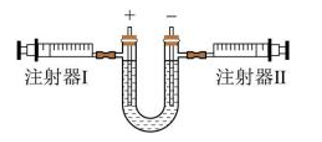
[探究过程]同学们进行了如图甲所示的实验。
结合资料,同学们得出了结论:复分解反应发生的条件是。
从上面的探究过程中,同学们也可以得出“证明化学反应能发生的思路是证明有新物质生成或的结论。