
 B . 称取氯化钠
B . 称取氯化钠 D . 测溶液的
D . 测溶液的
物质 | 橘子 | 西瓜 | 牙膏 | 肥皂 | 草木灰 |
pH | 3~4 | 5~6 | 8~9 | 10 | 11 |

 B .
B .  C .
C .  D .
D . 
在人体中,钠元素具有重要的生理功能,如维持水分、维持酸碱平衡、维持血压等。我国居民每日通过食品或调料获得钠元素的主要来源如图1所示。2021年我国某省份人均每日食盐摄入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的对比如图2所示。

事实证明,我国居民的膳食结构中钠元素过多,钾元素过少,这样易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐,但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。
超市中常见的深并岩盐和低钠岩盐成分配料表如下:
种类 | NaCl(g/100g) | KCl (g/100g) | KIO3(以I计)(mg/kg) | K4Fe(CN)6{以[Fe(CN)6]4-计}(mg/kg) |
深井岩盐 | ≥98.5 | 0 | 18~33 | ≤10 |
低钠岩盐 | 65~80 | 20~35 | 18~33 | ≤10 |

实验步骤 | 实验现象 | 实验结论 |
分别用a、b、c三支试管取样,各加入一定量碳酸钠溶液 | a中有气泡产生 | a中物质是 |
b中无明显现象 | b中物质是食盐水 | |
c中 | c中物质是澄清石灰水 |
写出a试管中发生反应的化学方程式: 。把c试管反应后的物质进行过滤,得到滤液。
猜想一:Na2CO3和NaOH;猜想二:NaOH;猜想三:。
提示:Ca(OH)2微溶于水。
实验步骤 | 实验现象 | 实验结论 |
取一定量滤液于试管中,加入一种盐溶液(写溶质化学式)。 | 有白色沉淀 | 猜想一正确 |
写出上述有白色沉淀生成的化学方程式:。
同学们还对a试管反应后废液的酸碱性感兴趣,决定用pH试纸测定其pH值。
用pH试纸测定a试管反应后废液酸碱性的过程 | 测定结果 |
在白瓷板上放一小片pH试纸,用玻璃棒蘸取。 | pH<7(废液显酸性) |
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体;
资料2:FeSO4容易被空气中的O2氧化。

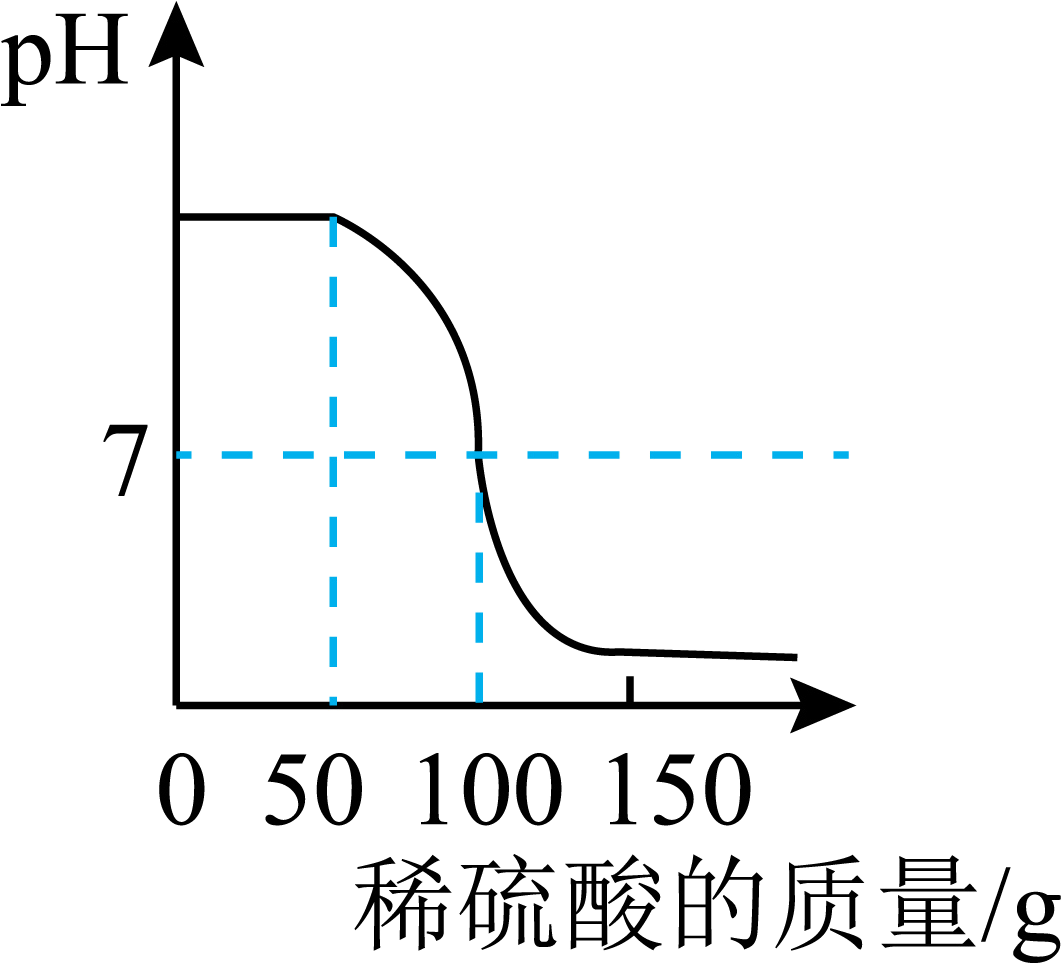
回答下列问题: