 B . 蚕丝纺织
B . 蚕丝纺织  C . 火药应用
C . 火药应用  D . 粮食酿酒
D . 粮食酿酒 


 C . 检查气密性
C . 检查气密性  D . 熄灭酒精灯
D . 熄灭酒精灯 
选项 | 实验目的 | 实验方法 |
A | 除去CO2中的少量CO | 点燃 |
B | 鉴别石灰水和NaOH溶液 | 加入适量的紫色石蕊溶液 |
C | 鉴别H2 和CH4 | 分别点燃,在火焰上方罩一干冷烧杯 |
D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入CuSO4溶液中 |


选项 | 横坐标 | 纵坐标 |
A | 向一定量稀硫酸中加入锌粉的质量 | 产生氢气的体积 |
B | 向一定量的铜粉中加入硝酸银溶液的质量 | 固体的质量 |
C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
D | 在一定温度下,向一定量的水中加入食盐晶体的质量 | 溶液中溶质的质量分数 |
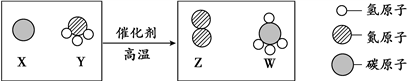
①用“ ![]() ”表示的物质,固态时俗称为。
”表示的物质,固态时俗称为。
②同温同压下,气体的体积比等于分子个数比。若空气中其它成分忽略不计,下图可表示空气微观模型的是。

①白磷燃烧的化学方程式为。
②整个实验过程中,瓶内水面的变化是。

【制备材料】1.5g小苏打、1.5g柠檬酸、蔗糖、果汁、凉开水、500 mL饮料瓶
【制备流程】

【查阅资料】打开汽水瓶盖,瓶内压强减小,气体的溶解度减小,会有大量气体逸出。喝汽水后会打嗝,因为汽水到胃中后,温度升高,气体的溶解度减小。
【问题讨论】
I | II | |
问题 | 步骤②中为什么要用凉开水制汽水? | 步骤③旋紧瓶盖后,为什么汽水中的气泡会由多变少直至不再冒出? |
答案 |
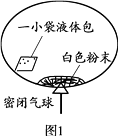
【查阅资料】
①该气球的充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
②氯化钙水溶液呈中性,碳酸钠、碳酸氢钠的水溶液均呈碱性。
③用一定溶质质量分数的NaHCO3和Na2CO3溶液进行实验,实验现象记录如下:
|
|
NaHCO3溶液 |
Na2CO3溶液 |
|
加入澄清石灰水 |
溶液变浑浊 |
溶液变浑浊 |
|
加入CaCl2溶液 |
无明显变化 |
溶液变浑浊 |
|
加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
室温时,用pH试纸测得溶液的pH=3,则该溶液呈性。
【猜想与假设】甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学认为是碳酸钠和碳酸氢钠的混合物。
【进行实验】
①将少量白色粉末放入水中搅拌,观察到,说明甲同学的猜想不正确。
②室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%的盐酸(装置如图2),记录如下表:

|
实验编号 |
锥形瓶内物质 |
最终得到CO2体积/mL |
|
|
名称 |
质量/g |
||
|
Ⅰ |
碳酸氢钠 |
0.10 |
V1 |
|
Ⅱ |
碳酸钠 |
0.10 |
V2 |
|
Ⅲ |
白色粉末 |
a |
V1 |
【解释与结论】
③实验Ⅰ的化学方程式为。
④表中a=;V1V2(填“>”、“<”或“=”)。
⑤上述实验得出的结论及判断依据是。
老师指出还可以采用更简单的方法得出与上述实验(2)相同的结论,实验方案为。
一段时间以来,网传隔夜菜、肉类腌制品不能吃,是因为含亚硝酸盐。对于亚硝酸盐大家有众多疑问。
疑问一:亚硝酸盐是什么东西?
亚硝酸盐是一类无机化合物的总称,主要指亚硝酸钠(NaNO2),它是白色或淡黄色粉末,有咸味,易溶于水。它是一种常见的食品添加剂,广泛用于各种火腿、酱卤肉等熟肉类食品加工,作为防腐剂和护色剂。国家对食品中含有的亚硝酸盐的最大含量限定为:蔬菜4 mg/kg,肉类3 mg/kg。
疑问二:亚硝酸盐的“毒”从何来?
亚硝酸盐本身并无致癌效应,它被吸入血液1~5分钟后,就已经分解。亚硝酸盐在胃中酸性环境下,易与氨基酸的分解产物发生反应,产生致癌物。当摄入维生素C时可以阻止致癌物产生。
疑问三:隔夜菜中的亚硝酸盐含量会超标吗?
实验人员准备了清炒菠菜、清炒芹菜和小白菜炒肉,三种菜各自被分成6份,常温和冷藏条件下各保存一半。实验人员分别取1小时后、6小时后、20小时后的剩菜,经过捣碎、提取、离心、过滤,取出汤汁。通过比色法逐一测得样品中亚硝酸盐含量,如下图所示。

实验结果表明,三种菜在放置20小时后,无论常温还是冷藏,亚硝酸盐含量虽均有增加,但都远未超过国家标准。
疑问四:摄入多少亚硝酸盐会对人体产生危害?
人体对亚硝酸盐的一次性安全摄入量为每千克体重0.2 mg。我们日常吃的大米、蔬菜、肉品里面几乎都含有亚硝酸盐。有数据显示,人体摄入的亚硝酸盐80%来自蔬菜。如果你体重50 kg,即使一次性吃2.5 kg蔬菜也是安全的。因此,将亚硝酸盐摄入量控制在安全范围内不会对人体造成危害。
依据文章内容,回答下列问题。
实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
1 g大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
10 g盐酸(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |

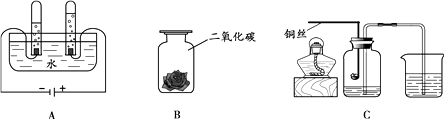
若A装置的锥形瓶中放一小块白磷,白磷不燃烧。分液漏斗中放入80℃的热水,打开K1 , 使热水流入锥形瓶中浸没白磷,关闭K1 , 白磷仍不燃烧。打开K2、K3 , 待液体注入锥形瓶后关闭K3 , 观察到A中有气泡产生且白磷燃烧,则B中反应的化学方程式为,由此得出可燃物燃烧的条件是。
若A装置的锥形瓶中放入滴有酚酞的氢氧化钙溶液,分液漏斗中盛放足量的稀盐酸,B装置的锥形瓶中充满二氧化碳,分液漏斗中盛放一定量的氢氧化钠溶液。
①实验时,打开K1 , 滴入稀盐酸至A中溶液恰好变为无色,关闭K1 , A中反应的化学方程式为。
②后续实验过程中观察到A中液体流入B中,B中溶液变红且变浑浊,产生该现象的实验操作是,使A中液体流入B中的原因是。


试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
上述工业流程中,处理相同量的SO2 , 双碱法所需的原料成本比用NaOH直接吸收更低,原因是。

①铁 ②稀盐酸 ③氧化铁 ④稀硫酸

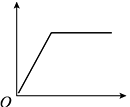
①请解释xy段温度变化的原因。
②在z处溶液中的溶质是(填化学式)。
