选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |

选项 | 目的 | 操作 |
A | 配制100mL1.0mol•L﹣1CuSO4 溶液 | 将25.0gCuSO4•5H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 Na2CO3+CO2↑+H2O
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
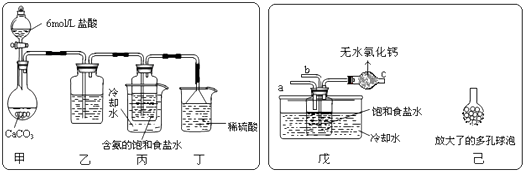
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从管通入气体,再从管中通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是;
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | ﹣ | 315 | ﹣ |
熔点/℃ | ﹣70.0 | ﹣ | ﹣ | ﹣ |
升华温度/℃ | ﹣ | 180 | 300 | 162 |
请回答下列问题:
①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是.
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10﹣2mol•L﹣1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是.若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol•L﹣1 | 体积/mL | 浓度/mol•L﹣1 | 体积/mL |
| |||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.
猜想②:(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是.
A.硫酸钾B.硫酸锰C.水 D.氯化锰.
用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.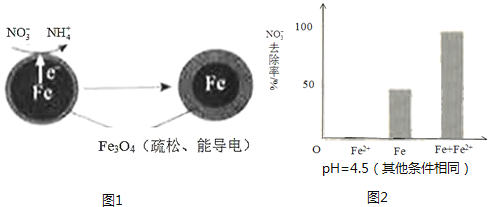
①作负极的物质是.
②正极的电极反应式是.
将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因:.
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因:.
I.氮是动植物生长不可缺少的元素,含氮化合物是重要的化工原料,研究CO、NOX等大气污染气体的处理具有重要意义.
(1)下列过程没有起到氮的固定作用的是 (填选项).
A.N2与O2反应生成NO B.NH3经催化氧化生成NO
C.N2和H2在一定条件下合成氨D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物
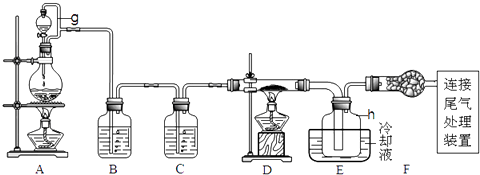
(2)实验室里可以选择下列实验装置中的 (填选项)制取氨气.
写出实验室制取氨气的化学方程式 ,检验氨气是否收集满的方法除用湿润的红色石蕊试纸以外还可以用 .
II.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)实验中用装置E制备Cl2 , 该反应的化学方程式为: ;若有6mol的HCl参加反应,则转移的电子的物质的量为 .
(2)①反应开始一段时间后,观察到B、D两个试管中的晶红溶液出现的现象分别是:B ,D .
②停止通气后,再将B、D两个试管分别加热,两个试管中的现象分别是:
B ,D .
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定 会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请结合离子方程式说明产生该现象的原因:
.
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:

(1)实验室常用装置E制备Cl2 , 指出该反应中浓盐酸所表现出的性质 ,
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的 、 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是: 、 ,并用离子方程式表示
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? .
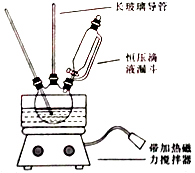
①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓)
![]() +H2O
+H2O
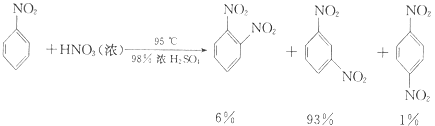
(ii)可能用到的有关数据列表如下
|
物质 |
熔点/℃ |
沸点/℃ |
密度(20℃)/g•cm﹣3 |
溶解性 |
|
苯 |
5.5 |
80 |
0.88 |
微溶于水 |
|
硝基苯 |
5.7 |
210.9 |
1.205 |
难溶于水 |
|
1,3﹣二硝基苯 |
89 |
301 |
1.57 |
微溶于水 |
|
浓硝酸 |
|
83 |
1.4 |
易溶于水 |
|
浓硫酸 |
|
338 |
1.84 |
易溶于水 |
请回答下列问题:

完成下列填空:
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
请回答下列问题:
i→→→→→→→a
①样品称量;
②加入溶液(填化学式),搅拌;
③(填操作名称);洗涤;干燥
④称量碳酸钙.
【实验Ⅰ】
试剂:酸化的0.5mol•L﹣1FeSO4溶液(pH=0.2),5% H2O2溶液(pH=5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
试剂:未酸化的0.5mol•L﹣1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
操作 | 现象 |
取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
将上述混合物分离,得到棕黄色沉淀和红褐色胶体.取部分棕黄色沉淀洗净,加4mol•L﹣1盐酸,沉淀溶解得到黄色溶液.初步判断该沉淀中含有Fe2O3 , 经检验还含有SO42﹣ . 检验棕黄色沉淀中SO42﹣的方法是.
i. H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设 i,理由是
②实验验证假设 ii:取,加热,溶液变为红褐色,pH下降,证明假设 ii成立.
若用FeCl2溶液替代FeSO4溶液,其余操作与实验 II相同,除了产生与 II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色.
产生刺激性气味气体的原因是.
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
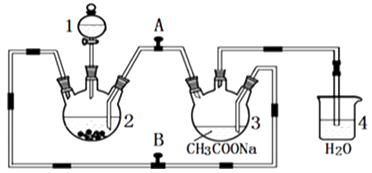
请回答下列问题:
A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液