选项 | 实验 | 现象 | 结论 |
A | 甲烷与氯气在光照下反应,将反应后的气体通入紫色石蕊试液中 | 紫色石蕊试液变红 | 反应后的气体是HCl |
B | 向正己烷中加入催化剂,高温使其热裂解,将产生的气体通入溴水中 | 溴水褪色 | 裂解产生的气体是乙烯 |
C | 向FeCl3溶液中滴入几滴30%的H2O2溶液 | 有气体产生,一段时间后,FeCl3溶液颜色加深 | Fe3+能催化H2O2分解,该分解反应为放热反应 |
D | 向某溶液中滴加氢氧化钠稀溶液后,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液无NH4+ |
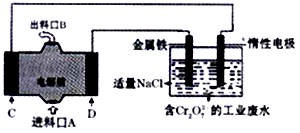
I.称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用c mol/LNa2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液VmL(滴定反应为:2 Na2S2O3+ I2=Na2S4O6+2NaI)。回答下列问题:

为了将含碘废液中的I2完全转化为I-而进入水层,向含碘度液中加入了稍过量的A溶液,则A应该具有性。


其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离了方程式是:、。为提高钛矿石的碱浸出速率,步骤I可采取的办法除提高碱的浓度外,还可以采取的办法有、(写出两种方法)。
②步骤II中加入Fe的目的是;分离出FeSO4晶体的操作是。
③步骤III形成的TiO2·nH2O 为胶体,其反应的化学方程式为。
方法一: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是,可能生成的气体是。
方法二: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) TiCl4(g)+O2(g) △H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是。

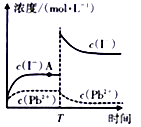
①Z曲线对应的温度是,判断的依据是。
②从图中可以得出的结论是(写两条)、。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型

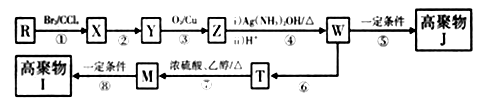
芳香烃R的分子式为C9H10 , 其苯环上只有一个取代基,R与H21:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。
已知: R'CH=CH2 R'CH2CH2Br
回答下列问题:
①能发生银镜反应②和氯化铁溶液反应显紫色③能使溴的四氧化碳溶液褪色
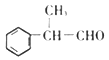 的合成路线(无机试剂任选):。
的合成路线(无机试剂任选):。