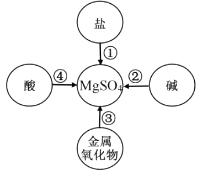



①过滤得到的固体可能有Ag、Cu、Al ②滤液的质量可能比废液质量小
③溶液中一定有硝酸铁和硝酸铝
④向滤渣中滴加盐酸,有气泡产生,溶液中一定没有硝酸银和硝酸铜
⑤向滤液中滴加盐酸,可能有沉淀产生


①Mg2+
②Mg2+和Fe2+
③Fe2+和Cu2+
④Mg2+、Fe2+和Cu2+
A.氯化钡溶液 B.氢氧化铜 C.氢氧化钠溶液 D.锌粒
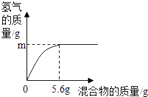
下列说法不正确的项是。
a. 若混合物为Zn、Al,则可能是0.2g
b. 若混合物为Zn、Cu,则m=0.2g
c. 若混合物为Fe、Al,则稀盐酸中溶质质量分数一定小于7.3%
d. 若混合物为Fe、Cu,m=0.1 g,则该混合物中Fe的质量分数可能是50%
① Cl2 + 2NaBr = Br2 + 2NaCl ② Br2 + 2NaI = I2 + 2NaBr
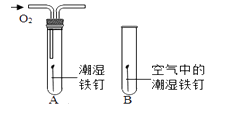


请分析数据,回答下列问题:

请回答下列问题:

序号 | 实验过程 | 实验现象 |
① | 锌粉和铁粉分别与10%反应 | 锌粉产生气体的速率快 |
② | 铁粉和铁片分别与10%盐酸反应 | 产生气体的速率快 |
③ | 铁片分别与5%和10%盐酸反应 | 10%盐酸产生气体的速率 |
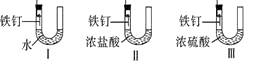
通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种.此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越(填“快”或“慢”).
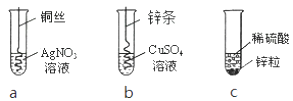
①铝片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序,还需另补充一个实验来达到实验目的,以下不可行的是 (填序号);
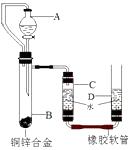
①连接装置并检查装置气密性;②加入药品和水;③如图所示,记录C中液面刻度(C为量气管,带有刻度的玻璃管,D为水准管); ④由A向B中滴加试剂至过量;⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。请根据上述实验步骤,回答下列问题:
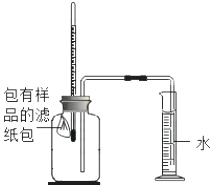
记录起始和最终量筒的读数以及所需时间如下表:
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
① | 1g铁粉、0.2g碳和10滴水 | 100 | 71 | 约120 |
② | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 71 | 约70 |
③ |
| \ | \ | \ |