 B . 取液时挤入空气
B . 取液时挤入空气  C . 滴加液体
C . 滴加液体  D . 取适量液体
D . 取适量液体 



| 选项 | 主要成分 | 所含的杂质 | “高效试剂” |
| A | HNO3 | H2SO4 | Ba(NO3)2 |
| B | NaOH | Ca(OH)2 | Na2CO3 |
| C | CuO | Fe | HCl |
| D | MgCl2 | MgSO4 | BaCl2 |

甲 | 乙 | 丙 | 丁 | 戊 | |
A | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
B | 硝酸银 | 铁 | 稀盐酸 | 氢氧化钡 | 碳酸钙 |
C | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
D | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |

①Mg2+
②Mg2+和Fe2+
③Fe2+和Cu2+
④Mg2+、Fe2+和Cu2+

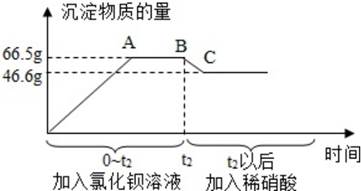
第一步:取50g该样品溶于水得到无色溶液;
第二步:再向第一步得到的无色溶液中,先后逐滴加入过量氯化钡溶液和过量的稀硝酸。产生沉淀的物质的质量与时间的关系如图所示,下列说法正确的是( )

A.烧碱溶液 B.纯碱溶液 C.氯化钡溶液 D.食盐溶液
试剂 | NaCl溶液 | 盐酸 | NaHCO3溶液 | NH4Cl溶液 | NaOH溶液 |
颜色 | 紫 | 红 | 蓝 | 红 | 蓝 |

①稀盐酸②KNO3
③CaCl2溶液④MgSO4溶液
②若将滤出金属放入盐酸中,有气泡产生,则滤液中一定存在的阳离子是。


溶质质量分数 溶液 | 2% | 3% | 4% |
Ca(NO3)2溶液 | 0.09A | 0.14A | 0.18A |
Ba(NO3)2溶液 | 0.06A | 0.09A | 0.11A |

根据以上实验回答:
①按图组装仪器,称量5g样品1放入锥形瓶中,加入足量稀盐酸;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③再称量5g样品2,重复以上实验.
[实验结果]以曲线图呈现,如图

[实验结论]两位同学通过简单计算,认为样品1是什么?理由是.
[反思与拓展]
两位同学的称量无误,但在两次实验中,干燥管内物质的增重均(填“大于”或者“小于”)理论值,请你帮助他们找出一个可能的原因:.
步骤 1:调节天平平衡;
步骤2:将等质量,质量分数都为10%的稀盐酸倒入烧杯内,分别放在天平的左右两盘;
步骤3:将等质量的锌粉和铁粉分别放入左,右烧杯内,观察天平的平衡情况;
步骤4:根据观察到的现象,得出结论。


【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行.②了解到某些难溶性盐的溶解能力和颜色.
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成.再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀.
【分析讨论】
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应.

【查阅资料】Na2SO4溶液、NaCl溶液呈中性。
【提出猜想】
猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl和;
猜想3:Na2SO4、NaCl和H2SO4;
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3。
【交流讨论】小强同学认为猜想4一定是错误的,他的理由是(用化学方程式表示)。
【进行实验】小明同学设计如下两个实验方案:
| 实验步骤 | 实验现象 | 实验结论 | |
| 方案一 | 取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 | ① | 猜想3正确 |
| 方案二 | 取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 | ② |
请写出方案二中有关反应的化学方程式: ③
【反思与总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。

|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/克 |
3.0 |
3.0 |
3.0 |
|
反应前总质量/克 |
193.8 |
194.6 |
193.6 |
|
反应后总质量/克 |
192.6 |
193.6 |
192.5 |
|
二氧化碳质量/克 |
请计算药片中碳酸氢钠的质量分数。

|
次数 |
一 |
二 |
三 |
四 |
五 |
六 |
|
加入稀硫酸的质量/g |
20 |
20 |
20 |
20 |
20 |
20 |
|
烧杯中剩余物的质量/g |
29.96 |
49.92 |
m |
89.84 |
109.8 |
129.8 |



当A装置中不再有气体产生时测得B装置的质量增加了4.6g;C装置的质量没有发生变化且无明显现象。请回答: