选项 | 实验 | 现象 |
A | 将氢氧化钠固体放在表面皿上,放置一会儿 | 固体受潮,逐渐溶解 |
B | 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 | 溶液变红 |
C | 向盛有氢氧化钠溶液的试管中滴加稀盐酸 | 有氯化钠生成 |
D | 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 | 产生蓝色沉淀 |
选项 | 试剂 | 现象和结论 |
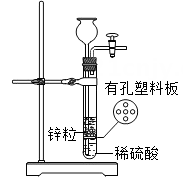
A | Zn 粉 | 有气泡产生,则溶液 a 一定有 MgCl2 |
B | CuO 粉末 | 无明显现象,则溶液 a 一定有两种溶质 |
C | NaOH溶液 | 无明显现象,则溶液 a 可能有 NaOH |
D | CuSO4 溶液 | 有蓝色沉淀,则溶液 a 一定有两种溶质 |
①氢氧化钠溶液、氯化镁溶液、硝酸;②氯化钡溶液、硝酸钠溶液、稀硫酸;③氯化铜溶液、氯化亚铁溶液、锌粒;④氯化钠溶液、硝酸银溶液、盐酸;⑤硫酸铁溶液、硝酸钠溶液、氢氧化钡溶液;
 B .
B . 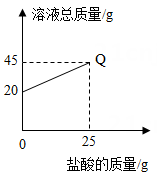 C .
C . 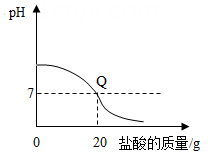 D .
D . 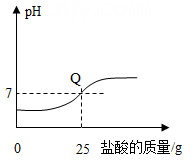
①将固体溶于水得无色透明溶液,加入足量 BaCl2 溶液过滤后得到 5 克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有 3 克白色沉淀。 ③在滤液中滴加 AgNO3 溶液产生白色沉淀。 则该固体中一定含有( )
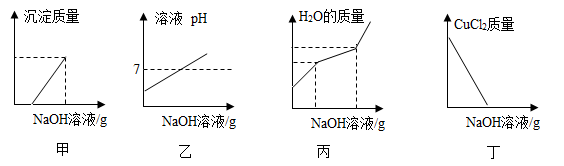
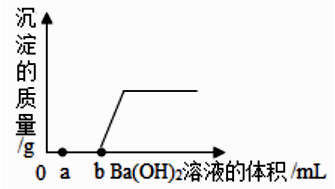

【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行;
②了解到某些难溶性盐的溶解能力和颜色,AgCl 是一种难溶于水的白色沉淀,AgI 是一种难溶于水的黄色沉淀。
【实验验证】取一支试管,加入少量 AgNO3 溶液,再加入过量 NaCl 溶液,有白色沉淀
生成,再往该试管中加入少量 KI 溶液,白色沉淀转化为黄色沉淀。
【评价讨论】
实验一:Na2CO3+H2SO4 实验二:Ba(NO3)2+H2SO4 实验三:NaOH+H2SO4
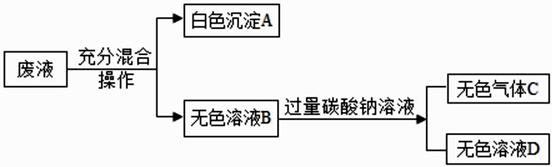
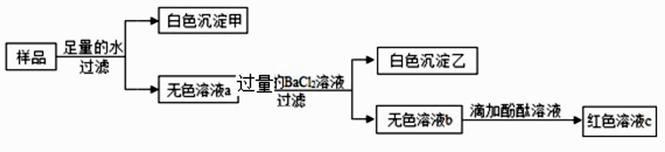
①白色沉淀 A 是;
②关于无色溶液 B 成分的猜想中,合理的是。
A.一定有 NaNO3 , 可能含有 NaOH
B.一定有 NaNO3 , 可能含有 HNO3 和 H2SO4
C.一定有 NaNO3 和 HNO3 , 可能含有 H2SO4
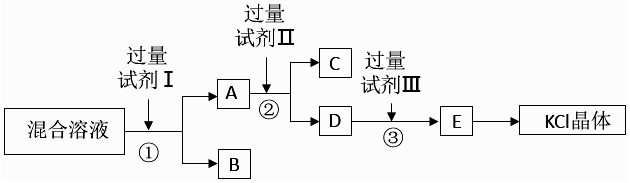
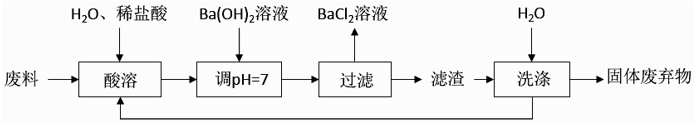
滤渣必须经过充分洗涤,确保其中 Ba2+含量达到规定标准才能作为固体废弃物处理,检
验 Ba2+的试剂可用,洗涤滤渣的主要目的是。
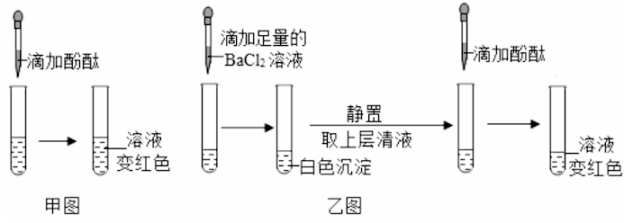
2C6H8O7 + 3Na2CO3 =2C6H5O7Na3 + 3CO2↑+ 3H2O。
他用一瓶 500mL 的雪碧做了如下实验:
实验步骤 | 步骤一 | 步骤二 | 步骤三 | 步骤三 |
操作过程 | 倒出三分之二雪碧,测其 pH | 在剩余雪碧中加入约6gNa2CO3 | 立即盖上瓶盖、摇匀 | 测溶液 pH |
现象或结果 | pH 约为 3 | 产生大量气泡 | 气泡消失,瓶子略瘪 | pH 约为 9 |
【提出猜想】①CO2 被溶解了;②CO2 与 H2O 发生了反应;③CO2 与 Na2CO3 溶液发生了 反应。
小思否定了猜想①和②,其理由是。
编号 | 实验一 | 实验二 | 实验三 | 实验四 |
实验装置 |
|
|
|
|
操作过程 | Na2CO3 溶液中滴加CaCl2 溶液 | Na2CO3 溶液中通入过量 CO2 滴加 CaCl2 溶液 | 收集一瓶 CO2 , 加入30mL饱和Na2CO3 溶液中,盖上瓶盖摇匀 | 加入将实验三的溶液 低温蒸发、干燥,得到的白色粉末按如图所示装置进行实验 |
实验现象 | 实验产生白色沉淀 | 无明显变化 | 瓶变瘪,瓶底有晶体析出 | A 试管口有水滴,澄清石灰水变浑浊 |
根据实验探究过程,回答下列问题:
①设计实验一的作用是。
②实验四中 A 试管口略向下倾斜,其目的是。
③根据实验探究得出:CO2 与 Na2CO3 溶液反应的化学方程式是。
综合分析上述实验,回答下列问题:
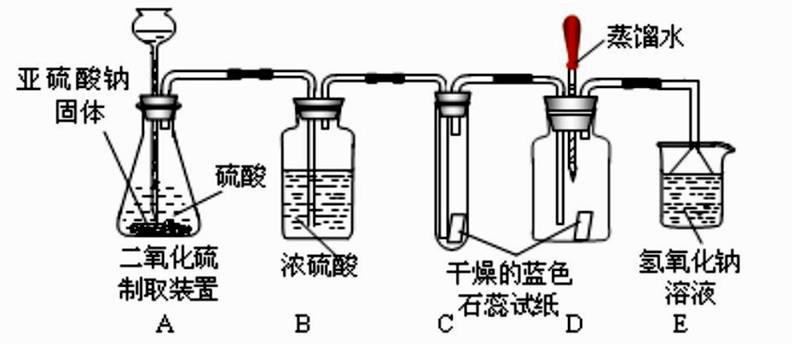
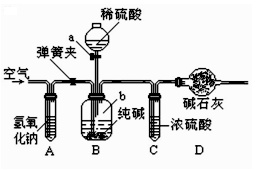
Ⅰ.查阅资料:该实验小组需要掌握的资料内容中包括:①二氧化硫易溶于水,②酸能使湿润的蓝色石蕊试纸变红,③SO2 不与浓硫酸反应,④二氧化硫有毒,能与氢氧化钠溶 液反应。
Ⅱ.实验:①实验过程中装置 C 内石蕊试纸的颜色始终没有变化,这说明。
②装置 D 中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此现象说明,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红。此现象说明。
Ⅲ.结论:原假设(填“成立”或“不成立” )。

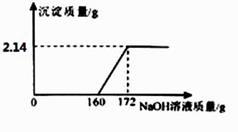
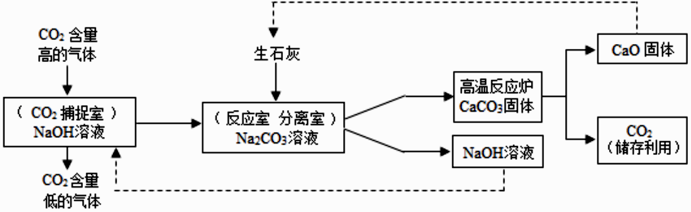
论上可生成 CaCO3 的质量(要求根据化学方程式计算)。
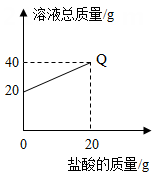
①称取纯氢氧化钠和待测氢氧化钠各 mg 分别配成 25.0g 溶液,均滴加酚酞试液 2~3 滴。
②把 12.0%的盐酸逐滴加入实验①配成的两种溶液中,当酚酞试液刚好由红色变为无色 (溶液呈中性)时,纯氢氧化钠配成的溶液消耗盐酸 n1g,待测氢氧化钠配成的溶液消耗盐酸 n2g。