| 操作 | 现象 | 结论 | |
| A | 加入浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| B | 加入苯,振荡、静置 | 分层,下层溶液显橙红色 | 原溶液中一定有溴单质 |
| C | 滴加氯化钡溶液,再加盐酸 | 白色沉淀产生 | 一定有SO42- |
| D | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液一定含钠盐 |
| 选项 | 被检验的物质 | 使用的试剂或方法 | 实验现象 |
| A | Fe3+ | KSCN溶液 | 溶液出现血红色沉淀 |
| B | SO2 | 品红溶液 | 品红溶液褪色,加热不能复原 |
| C | Na+ | 用铂丝蘸取少量溶液在火焰上灼烧 | 透过蓝色钴玻璃看到紫色火焰 |
| D | NH4+ | NaOH溶液、石蕊试纸 | 加入NaOH溶液后加热,产生的气体使湿润的红色石蕊试纸变蓝 |
A | B | C | D |
从碘水中分离出碘 |
检验溶液中NH4+的存在 |
干燥SO2气体 |
收集HCl气体 |
| 操作 | 结论 | |
| A | 将火柴梗伸入溶液中 | 变黑者为浓硫酸 |
| B | 加入金属铝片 | 产生刺激性气味者为稀硫酸 |
| C | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| D | 加到CuSO4·5H2O晶体中 | 变白者为浓硫酸 |


|
物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
|
SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2 |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

a.NaOH 溶液
b.NaCl 溶液
c.H2O
d.NH4Cl 溶液
a.水
b.酸性 KMnO4 溶液
c.饱和 NaHSO3 溶液
d.浓溴水
①有一定量的余酸但未能使铜片完全溶解,你认为原因是。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的物质是(填字母)。
a.BaCl2 溶液
b.锌粉
c.紫色石蕊试液
d.滴有酚酞的 NaOH 溶液
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设
假设1:只存在SO32-;假设2:即不存在SO32- , 也不存在ClO-;假设3:。
②设计实验方案,进行实验。请完成下列表格,写出相应的实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH溶液、0.01 mol·L-1酸性KMnO4溶液、淀粉KI溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量吸收液分置于A、B试管中 |
|
|
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 |
a.若溶液褪色,则假设1成立 |
|
b.若溶液不褪色,则假设2或3成立 |
|
|
步骤3: |
|

【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
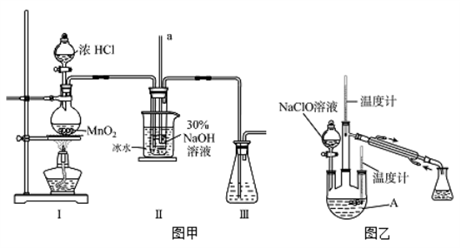
实验装置如上图图乙所示,反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为。
探究设计1:若要检验A中所得气体含有SO2 , 可将混合气体直接通入(填装置代号,下同)装置;若要检验A中所得气体含有乙烯,可将混合气体直接通入。
①设计2中①→②→③装置对应的装置分别是(填装置代号)。
②设计2中能说明二氧化硫气体存在的现象是。
③使用装置②的目的是。使用装置③的目的是。
④设计2中确认乙烯气体存在的现象是。
探究设计3:若要一次性将乙烯、CO2、SO2三种气体全部检验出来,气体被检验出来的先后顺序是,气体通过装置的顺序为A→(填装置代号)。

回答下列问题:
(查阅资料)
① ![]()
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
CuCl+O2+ =3CuO·CuCl2·3H2O+HCl
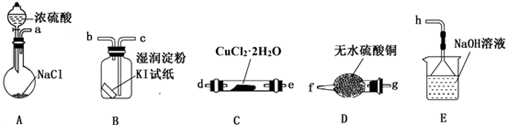
装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和性;
①连接装置,;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是;
装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题: