| A | B | C | D |
| 燃气灶 | 硅太阳能电池 | 碱性锌锰电池 | 风力发电机 |
| | | | |
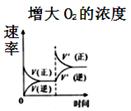 B .
B . 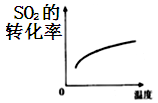 C .
C . 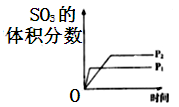 D .
D . 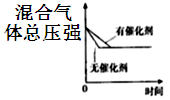
| 实验事实 | 相关平衡 | |
| A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O |
| B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH- |
| C | 溶有CO2的正常雨水pH≈5.6 | H2O+CO2 |
| D | CaCO3固体溶于盐酸 | CaCO3(s) |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述错误的是(溶液体积变化忽略不计)()


②取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.
下列分析错误的是()
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法错误的是()
图1  图2
图2 



已知1:生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
已知2:几种难溶电解质的溶解度(20℃)
| 物质 | 溶解度/g |
| Fe(OH)2 | 5.2×10-5 |
| Fe(OH)3 | 3×10-9 |
| MgCO3 | 3.9×10-2 |
| Mg(OH)2 | 9×10-4 |
(已知:Fe2+氢氧化物呈絮状,不易从溶液中除去)
请回答:
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色。说明漂液具有的性质是。
②用化学用语表示NaClO溶液使pH试纸变蓝的原因。
③步骤Ⅱ中漂液的主要作用是。
④若用H2O2代替漂液,发生反应的离子方程式为。
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4kJ/mol
则N2(g)+3H2(g) 2NH3(g) ΔH=kJ/mol
|
N2 |
H2 |
NH3 |
|
|
投料Ⅰ |
1.0mol/L |
3.0mol/L |
0 |
|
投料Ⅱ |
0.5mol/L |
1.5mol/L |
1.0mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为。
②按投料Ⅱ进行反应,起始时反应进行的方向为(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ.X代表的物理量是。
ⅱ.判断L1、L2的大小关系,并简述理由。

①电极b上发生的是反应(填“氧化”或“还原”)。
②写出电极a的电极反应式。


ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作极。
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是。
|
实验序号 |
① |
② |
③ |
|
加入试剂 |
0.01mol/LKMnO4 0.1mol/LH2C2O4 |
0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 |
0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
|
褪色时间/s |
116 |
6 |
117 |
请回答:
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7

①表示滴定盐酸的曲线是(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为。
ⅱ.当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH7(填“>”、“=”或“<”)。