 C . 2个锌离子:2Zn+2
D . 60个碳原子:C60
C . 2个锌离子:2Zn+2
D . 60个碳原子:C60
 取用粗盐
B .
取用粗盐
B .  过滤粗盐水
D .
过滤粗盐水
D . 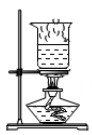 蒸干滤液
蒸干滤液
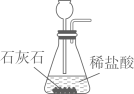 制取CO2
B .
制取CO2
B . 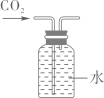 收集CO2
C .
收集CO2
C . 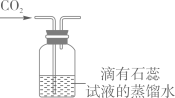 验证CO2能与水反应
验证CO2能与水反应
| 选项 | 物质(括号内为杂质) | 试剂及操作方法 |
| A | CO2 (H2O) | 通过装有生石灰的干燥管,干燥 |
| B | KCl固体(MnO2) | 加水溶解、过滤、蒸发滤液 |
| C | Fe粉(Cu粉) | 加入过量稀硫酸,过滤 |
| D | NaCl溶液(MgCl2) | 加入过量NaOH溶液,过滤 |
A  B
B  C
C  D
D  E
E 
②上述反应的理论产氧率为[产氧率 100%,结果精确到0.1%]。
③取一定量的高锰酸钾固体,充分加热,发现实际产氧率远高于上述数值,则可能的原因有(测定过程中产生的误差可忽略)。
a.未检查装置气密性即向大试管中加入高锰酸钾固体
b.当导管口有连续气泡均匀冒出时,开始收集氧气
c.集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
d.气体收集完毕后,先熄灭酒精灯,再将导管移出水面
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
MnO2用量/g |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
|
所用时间/s |
17 |
8 |
6 |
3 |
2 |
2 |
2 |
2 |
2 |
①写出上述反应的化学方程式:。
②该实验可得出的结论是。
①下列说法正确的是(填字母)。
a.硫酸钠在水中形成自由移动的Na+和SO42﹣ , 可增强水的导电性
b.电解过程中化学能转化为电能
c.电极N与电源负极相连
②电解后,管A中生成的微粒有(填微粒符号)。
注:δ(分布分数)表示某物质分子数占所有含碳物质分子总数的比例。
如δ(CO)
图中CO的分布分数先增后降的原因是。
已知:BaSO4是白色固体,难溶于水,也不与盐酸反应。
(第一组)选取5种溶液,如图所示进行实验。
|
实验 |
现象及结论 |
解释 |
|
| 试管A和B中无明显现象,不能确定反应是否发生。 | / |
| ⑴试管C中产生(填实验现象)。复分解反应已发生。 | ⑵试管C中减少的微粒是(填微粒符号) | |
| 试管D中有白色沉淀产生。复分解反应已发生。 | ⑶反应的化学方程式为 |
(第二组)对试管A和B中是否发生反应再探究,如图所示进行实验。
| 实验 | 现象及结论 | 解释 |
| | 试管E中,滴加酚酞试液后,溶液由无色变为红色;滴加一定量稀硫酸后,溶液由红色变为无色。复分解反应已发生。 | ⑷从微观粒子变化的角 度分析试管E中反应的实 质是。 |
| 试管F中始终无明显现象,不能确定反应是否发生。 |
(第三组)对试管B中是否发生反应继续探究,如图所示进行实验。
| 实验 | 现象及结论 | 解释 |
| | 试管G中溶液变红 | ⑸该实验的目的是为了检验试管G的溶液中存在(填微粒符号)。 |
| ⑹向试管H中滴加(填“试剂X”的化学式)溶液后,有白色沉淀产生。 | 溶液中有SO42﹣存在。 | |
| 结论 | NaCl溶液与稀硫酸不发生复分解反应。 | |

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
图1  图2
图2 
a.维生素C由C,H,O三种元素组成
b.维生素C的相对分子质量为176g
c.维生素C由6个碳原子、8个氢原子和6个氧原子构成
d.维生素C中C,H,O元素的质量比为9:1:12
相关数据如表:
|
物品 |
反应前 |
反应后 |
||
|
锥形瓶 |
蒸馏水 |
维C泡腾片 |
锥形瓶及瓶内所有物质 |
|
|
质量/g |
71.75 |
50.00 |
4.00 |
125.53 |
①根据以上数据计算本品中碳酸氢钠的质量分数(写出计算过程,结果精确到0.1%)。
②实验测定结果与题(2)计算结果相比有明显偏差,其可能原因是。