 用纸槽将固体粉末送入试管
B .
用纸槽将固体粉末送入试管
B .  倾倒液体
C .
倾倒液体
C .  加热试管内液体
D .
加热试管内液体
D .  熄灭酒精灯
熄灭酒精灯
物质 | 杂质 | 除杂所用的试剂和方法 | |
A | CO2气体 | HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
B | KCl晶体 | K2CO3晶体 | 加入稍过量的稀盐酸,蒸发结晶 |
C | CO2气体 | CO气体 | 点燃气体 |
D | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |

![]()
![]()
 向pH=13的氢氧化钠溶液中加水稀释
B .
向pH=13的氢氧化钠溶液中加水稀释
B .  用相同质量的氯酸钾固体加热分解来制取氧气
C .
用相同质量的氯酸钾固体加热分解来制取氧气
C .  向一定体积的氢氧化钠溶液中逐滴加入稀盐酸
D .
向一定体积的氢氧化钠溶液中逐滴加入稀盐酸
D .  向一定质量一定质量分数的稀盐酸中加入铁粉
向一定质量一定质量分数的稀盐酸中加入铁粉

①t1℃时,两物质中溶解度较大的是.
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是的溶液.
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的(填“饱和”或“不饱和”)溶液.保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数(填“变大”、“不变”或“变小”).
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是.
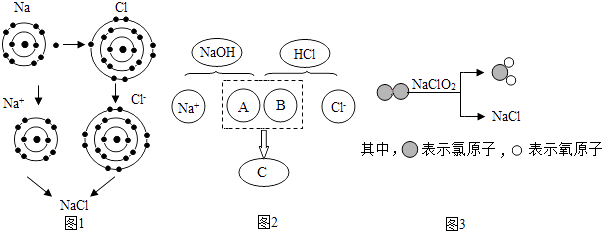
A.最外层电子数 B.内层电子数 C.质子数
![]()

①物质X是(填名称).
②写出反应I中发生反应的分步的化学方程式、.
③上述一系列转化过程中,没有涉及的基本反应类型是.
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
步骤为:计算、、稀释.经过计算可知需要浓盐酸的体积为mL,量取水时应选用规格(从10mL、50mL、100mL中选取)为mL的量筒.最后将稀盐酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是(填字母序号).
A.100g B.14.6% C.稀盐酸

【实验内容】:
编号 | 实验内容 | 实验现象 | 实验结论 |
① | 取反应后固体剩余物0.2g加 入5mL6%的H2O2溶液 | 剧烈反应,放热,产 生大量气泡 | 生成物中的MnO2 催化分解H2O2 |
② | 取0.2g Mn O2加入5mL........ 。 (填H2O2溶液的溶质质量分 数)的H2O2溶液 | 平稳反应,放热,持 续产生气泡 | MnO2催化分解 H2O2 |
③ | 取反应后固体剩余物1.0g,加 入足量水,充分溶解,过滤 | 固体完全溶解,滤纸 上无黑色固体残余物 | 固体剩余物中无 ........。 |
【实验分析】:
①完善上表中的填空内容:实验2,实验3.
②实验2的目的是.
③经讨论,实验1的结论不正确,理由是.
a.6KMnO4 2K2MnO4+K2Mn4O8+4O2↑
b.KMnO4 KMnO2+O2↑
④取8.0g KMnO4加热使之完全分解,生成O2的质量可能为(填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4的质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以(填“a”或“b”)为主.