 B .
B . 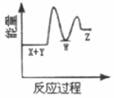 C .
C . 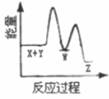 D .
D . 

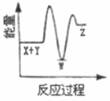
①1g氢气完全燃烧生成气态水放出120.9 KJ的热量
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
③Na2O2(s)+CO2(g)=Na2CO3(s)+ ΔH=-226 kJ/mol
在相同条件下根据以上信息回答下列问题:
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=。
|
H2(g) |
Br2(l) |
HBr(g) |
|
|
1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为。
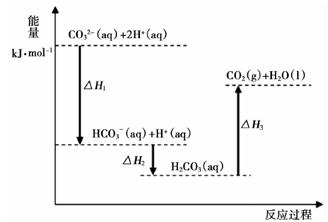
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1 , ΔH1=
①ΔH1(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会(填“增大”“减小”或“不变”,下同),平衡常数K会。
反应原理为2CO(g)+SO2(g)=2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
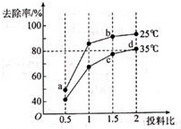
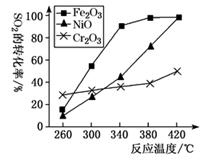
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是
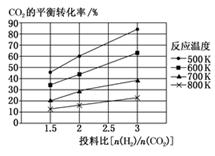
②若在2 L恒容密闭容器中,将3 mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是(填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2
已知:N2(g)+2O2(g)=N2O4(g)△H=10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式为 。
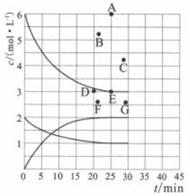
①下列能说明反应达到平衡状态的是(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00 mol N2和12.00 mol H2 , 则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为(选填字母)。
2NO2 N2O4(g) △H=-56.9 kJ·mol-1
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:

①计算0~20min时,v(N2O4)=。
②已知该反应v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时, ;改变温度至T1时,k1=k2 , 则T1373K(填“>”“<”或“=”)。

请回答下列相关问题:
2NO3-(aq)+10e-+12H+(aq)=N2(g)+6H2O(I)△H
反硝化过程实际分多步进行(全过程电子均来自作电子供体的同种有机物),其中的三步反应为:
NO3-(aq)+2e-+3H+(aq)==HNO2(aq)+H2O(I) △H1
HNO2(aq)+e-+H+(aq)=NO(g)+H2O(I) △H2
N2O(g)+2e-+2H+(aq)=N2(g)+H2O(I) △H3
则另一步反应2NO(g)+2e-+2H+(aq)=N2O(g)+H2O(Ⅰ)的反应热△H4=(用含△H、△H1、△H2、△H3的代数式表示)。水体中发生反硝化作用可减弱硝酸积累对水中生物的危害,但土壤中过多发生反硝化作用对农业生产不利,原因是 。
A.溶液的pH不再改变
B.NH4+的消耗速率和H+的生成速率相等
C.溶液中氮原子的总物质的量保持不变
D.断开3molO=O键的同时消耗2molH2O
实验测得在其它条件一定时,NH4+硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时,反应速率迅速下降的原因可能是。