| A | B | C | D | |
| 家庭常用消毒剂 | | | | |
| 有效成分 | 对氯间二甲苯酚 | 乙醇 | 次氯酸钠 | 过氧乙酸 |
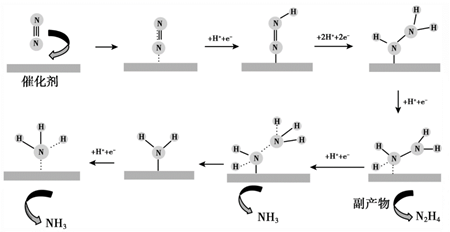
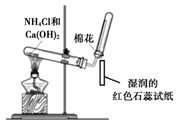 制取并检验氨气
B .
制取并检验氨气
B . 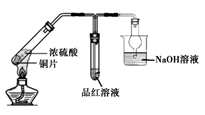 制取并检验SO2气体
C .
制取并检验SO2气体
C . 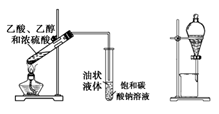 制取并提纯乙酸乙酯
D .
制取并提纯乙酸乙酯
D . 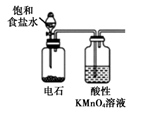 制取并检验乙炔
制取并检验乙炔

已知: ![]()
CH2=CH-CH3(g)+NH3(g)+ O2(g)→CH2=CH-CN(g)+3H2O(g) △H=-514.6kJ·mol-1
i:CH2=CH-CH3(g)+O2(g)→CH2=CH-CHO(g)+H2O(g) △H=-353.1kJ·mol-1
写出反应ii的热化学方程式:。
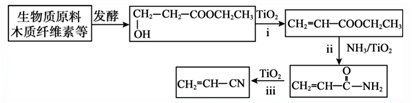
①写出ii的化学方程式:。
②丙烯腈与1,3-丁二烯共聚生产的丁腈橡胶是现代工业重要的橡胶。写出合成丁腈橡胶的化学方程式:。
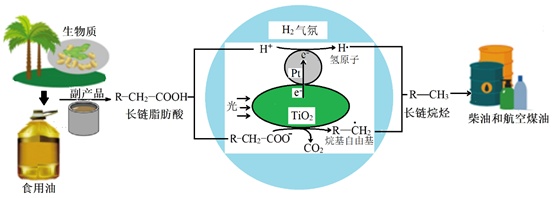
①油脂酸性水解可得高级脂肪酸和(写结构简式)。
②TiO2界面发生的电极反应式为。
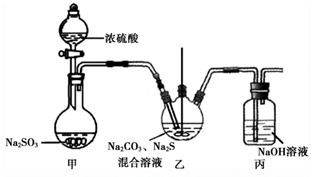
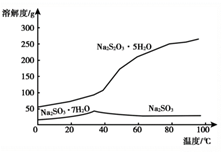
已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中发生反应的化学方程式为。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:。
③丙中,NaOH溶液吸收的气体可能有。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反应的原理为:i.Cu(NH3)42+
+ Au + 2S2O32− Cu(NH3)2+ + Au(S2O3)23−+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH−
浸金过程Cu(NH3)42+起到催化剂的作用,金总反应的离子方程式为:。
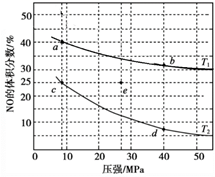
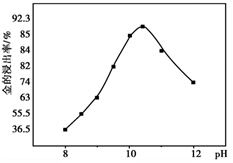
② 一定温度下,相同时间金的浸出率随体系pH变化曲线如如图,解释pH>10.5时,金的浸出率降低的可能原因。(写出2点即可)
实验记录如下:
|
| 实验 | 方案和现象 |
| ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
| ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
| ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
实验iv:
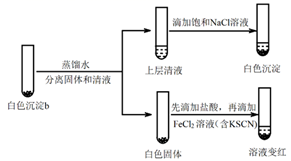
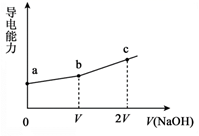
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是。
②FeCl2溶液的作用是。由此判断,白色沉淀b可能含有AgClO。
实验v:
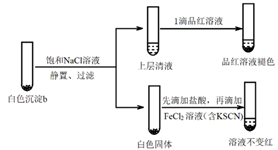
①结合离子方程式解释加入饱和NaCl溶液的目的:。
②推测品红溶液褪色的速率:实验iii比实验v(填“快”或 “慢”)。
a.M含有两种不同的官能团 b.M存在顺反异构体
c.M和G能用Br2的CCl4溶液鉴别 d.M能与NaOH溶液反应
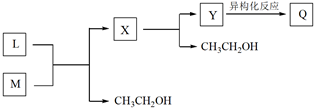
已知:上述异构化反应中,只存在氢原子和不饱和键的位置变化。Y的分子中含有两个六元环。Y的结构简式是。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入 溶液,充分反应后加入
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
| | | | |
| 初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
| 步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
| 步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
| 步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
①Fe2+浓度降低,滤渣中存在 。结合离子方程式解释原因:。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、。
① 酸性溶液的作用:。
②结合离子方程式说明MnCO3的作用: 。
①样品中MnCl2的质量分数是(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的 分解。若不加热,测定结果会(填“偏高”、“偏低”或“无影响”)。