 点燃镁条
B .
点燃镁条
B . 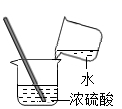 稀释浓硫酸
D .
稀释浓硫酸
D . 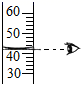 读取液体体积
读取液体体积
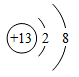 表示铝原子的结构示意图
D .
表示铝原子的结构示意图
D . 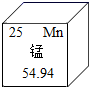 可知锰原子的相对原子质量为25
可知锰原子的相对原子质量为25
| 实验目的 | 实验方案 | |
| A | 分离硫酸钡和氯化钠固体 | 加足量水溶解、过滤、洗涤、干燥;蒸发结晶 |
| B | 除去氯化钙溶液中混有的少量盐酸 | 加入足量的碳酸钙,过滤 |
| C | 验证铝、铁、铜三种金属的活动性顺序 | 将打磨过的铝丝和洁净的铜丝,分别浸入到硫酸亚铁溶液中,观察现象 |
| D | 鉴别溶液:氯化钡溶液、氢氧化钠溶液、硫酸钠溶液、氯化铵溶液 | 不用其它试剂,将四种溶液分别取样,两两相互混合,观察现象 |

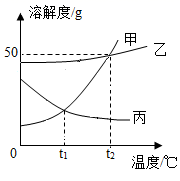
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
A 金属材料 B NH4NO3 C 有机合成材料 D 钙元素 E 糖类
探究一:脱脂棉燃烧的原因。
(作出猜想)根据燃烧条件分析:①脱脂棉是可燃物;②吹出的气体可能与过氧化钠反应生成了氧气:③反应放出热量,满足了温度达到脱脂棉的。
(进行实验)在如图所示装置中,向过氧化钠粉末中不断吹气,观察到过氧化钠粉末由淡黄色逐渐变为白色,在导管口P处放置,木条复燃,说明试管内生成了氧气。同时还观察到,说明反应还放出了热量。
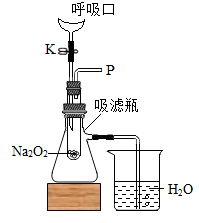
(得出结论)吹出的气体与过氧化钠反应生成了氧气,同时反应放出热量,满足了脱脂棉燃烧的条件。
探究二:试管内残留白色固体的成分。
(查阅资料)①吹出的气体主要成分有氮气、二氧化碳和水蒸气;
②过氧化钠与氮气不反应。
(作出猜想)猜想1:CO2参加反应,固体成分是Na2CO3;
猜想2:H2O参加反应,固体成分是NaOH;
猜想3:CO2和H2O均参加反应,固体成分是Na2CO3和NaOH。
(实验验证)
| 实验步骤 | 实验现象 | 实验结论 |
| ①取残留白色固体于试管中配成溶液,向其中加入足量的氯化钡溶液,静置 | 产生白色沉淀 | 固体成分含有碳酸钠 |
| ②取适量①的上层清液于试管中,向其中滴加少量氯化铜溶液 | 产生蓝色沉淀 | 固体成分含 |
(实验结论)过氧化钠与二氧化碳、水蒸气都能反应,猜想3正确。请写出过氧化钠与二氧化碳反应的化学方程式:。
(拓展延伸)化工厂存有过氧化钠时,一旦失火,不能选用(填字母序号)灭火。
A、二氧化碳灭火器
B、细沙
C、水基型灭火器