 B . 验证漂白性
B . 验证漂白性  C . 验证氧化性
C . 验证氧化性  D . 尾气处理
D . 尾气处理 

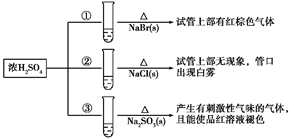
①HCl ②Cl2 ③Ca(ClO)2 ④HClO ⑤CO2




①向饱和Na2CO3溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴入过量的稀H2SO4
③向石灰水中通入CO2至过量
④CaCl2溶液中通入CO2至过量

组成X的三种元素是(填元素符号),X的化学式是。
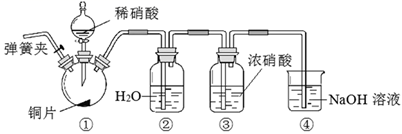
某同学认为虽然装置②液面上方的无色气体为NO,但不能说明装置①反应一定生成NO。理由是。
准确称取a g岩脑砂,与足量氧化铜混合加热(反应:2NH4Cl+3CuO 3Cu+N2↑+2HCl+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。

装置H中盛装的试剂是(填试剂名称)。

已知有关信息:
①Si+3HCl SiHCl3+H2 , Si+2Cl2
SiCl4
②SiCl4遇水剧烈水解,SiCl4的熔点、沸点分别为-70.0 ℃、57.7 ℃。
请回答下列问题:

上图装置的主要缺点是。
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ知浓盐酸具有的性质是 (填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是 (填化学式)
③D中发生反应的化学方程式是:。

Br2+ =
+Br-+CO2↑
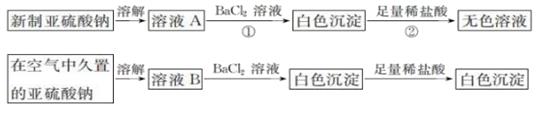
写出上述实验中②的离子方程式:。
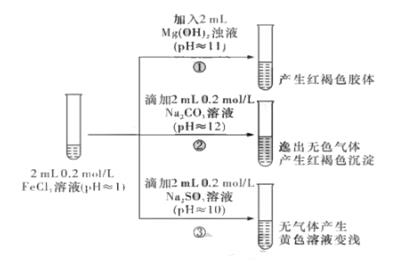
①中反应的离子方程式是._。
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液, 产生白色沉淀。得出结论:
FeCl3与Na2SO3 发生了氧化还原反应,离子方程式是_。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_。
①元素在周期表中的位置是(填所在周期和族);Y的化学式是。
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是mol。

请回答下列问题:
工业上冶炼单质 2 的化学方程式为
NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式

已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;
②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。请回答下列问题:
下列说法不正确的是
![]()
若生成1mol O2 , 该反应转移电子的物质的量为。
①A为(填写化学式)。实验室用两种固体共热制取A,写出此化学方程式:。
②D可以转化为B,则D→B反应的离子方程式:。